|
|
|
|
|
FMD | 精彩荐读:肿瘤来源的外泌体通过CD19抗原诱导CD19 CAR-T初始激活但通过TGF-β信号传导损害其功能 |
|
|
论文标题:Tumor-derived exosomes induce initial activation by exosomal CD19 antigen but impair the function of CD19-specific CAR T-cells via TGF-β signaling
期刊: Frontiers of Medicine
作者:Yuanyuan Hao , Panpan Chen, Shanshan Guo, Mengyuan Li, Xueli Jin, Minghuan Zhang, Wenhai Deng ,Ping Li, Wen Lei , Aibin Liang, Wenbin Qian
发表时间:15 Feb 2024
DOI:10.1007/s11684-023-1010-1
微信链接:点击此处阅读微信文章
导 读
浙江大学医学院附属第二医院钱文斌、雷文,同济大学附属同济医院梁爱斌等在Frontiers of Medicine发表研究论文《肿瘤来源的外泌体通过CD19抗原诱导初始激活,但通过TGF-β信号通路损害CD19特异性CAR-T细胞的功能》(Tumor-derived exosomes induce initial activation by exosomal CD19 antigen but impair the function of CD19-specific CAR T-cells via TGF-β signaling)。本研究发现B细胞淋巴瘤来源的外泌体通过外泌体CD19抗原初始激活CD19特异性嵌合抗原受体T细胞,同时通过转化生长因子-β-Smad3信号通路诱导嵌合抗原受体T细胞凋亡、免疫检查点表达上调及终末分化,而转化生长因子-β抑制剂LY2109761可逆转这些抑制效应,提示嵌合抗原受体T细胞联合转化生长因子-β抑制剂可能成为治疗难治性复发性B细胞淋巴瘤的新策略。
嵌合抗原受体T细胞疗法作为近年来肿瘤治疗领域的重要突破,在难治性和复发性血液系统恶性肿瘤治疗中展现出显著疗效。其中,靶向CD19的嵌合抗原受体T细胞疗法在B细胞恶性肿瘤治疗中应用广泛,但临床实践中仍有部分患者在初始缓解后出现复发,这主要与嵌合抗原受体T细胞体内功能障碍、持久性不足或肿瘤细胞表面靶抗原表达改变有关。尽管研究人员尝试通过多靶点抗原靶向、免疫检查点阻断等策略克服治疗抵抗,但嵌合抗原受体T细胞疗法的耐药机制仍有待深入探索。肿瘤来源的外泌体作为一种纳米级细胞外囊泡,广泛参与肿瘤微环境中的细胞间通讯,其携带的蛋白质、核酸等生物活性物质可抑制免疫细胞功能,促进肿瘤进展。然而,淋巴瘤来源的外泌体对嵌合抗原受体T细胞功能的具体影响及相关机制尚不明确,这一科学问题的阐明对于优化嵌合抗原受体T细胞疗法具有重要意义。
浙江大学医学院附属第二医院钱文斌、雷文,同济大学附属同济医院梁爱斌等通过一项研究系统探讨了B细胞淋巴瘤来源的外泌体对CD19特异性嵌合抗原受体T细胞功能的影响及其分子机制,并提出了联合转化生长因子-β(TGF-β)抑制剂改善嵌合抗原受体T细胞疗法疗效的新策略。
研究团队首先从Burkitt淋巴瘤细胞系Raji、急性淋巴细胞白血病细胞系Nalm-6及弥漫大B细胞淋巴瘤细胞系OCI-LY3中分离外泌体,通过动态光散射、透射电镜及蛋白质印迹法验证其形态特征与表面标志物。结果显示,Raji和Nalm-6细胞来源的外泌体表达CD19抗原,而OCI-LY3细胞来源的外泌体则不表达(图1)。进一步实验发现,短期暴露于含CD19的Raji外泌体可显著增强嵌合抗原受体T细胞的细胞毒性、增殖能力及细胞因子分泌,这一激活效应依赖于外泌体表面的CD19抗原——当使用CRISPR-Cas9技术敲除Raji细胞的CD19基因后,其外泌体对嵌合抗原受体T细胞的激活作用消失(图2)。
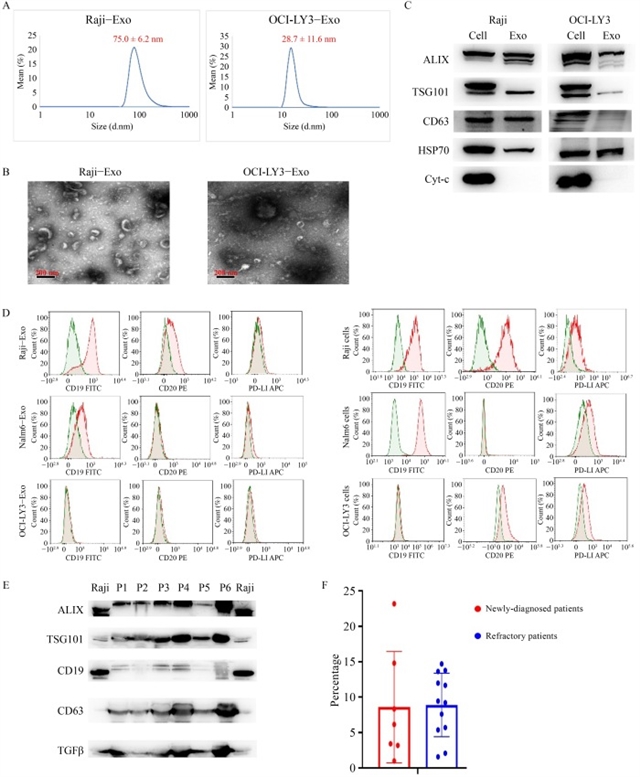
图1 B细胞恶性肿瘤外泌体的表征及表面标志物
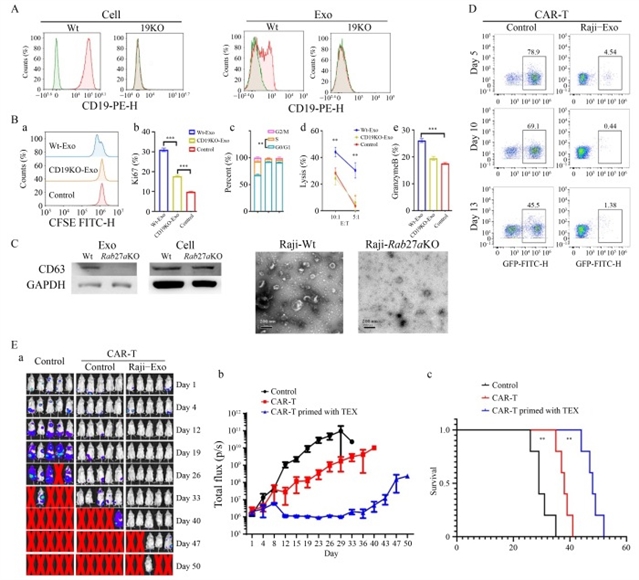
图2 CAR-T细胞的初始激活依赖于外泌体CD19抗原
然而,长期暴露实验揭示了淋巴瘤外泌体对嵌合抗原受体T细胞的抑制效应。流式细胞术分析显示,Raji外泌体处理使嵌合抗原受体T细胞表面程序性死亡受体1(PD-1)、T细胞免疫球蛋白黏蛋白3(TIM-3)、淋巴细胞激活基因3(LAG-3)等抑制性受体表达上调,细胞凋亡增加,同时效应T细胞比例升高,中央记忆性T细胞和初始T细胞比例降低(图3)。单细胞RNA测序进一步证实,外泌体处理后的嵌合抗原受体T细胞呈现终末分化表型,调节性T细胞特征基因FOXP3表达上调,而初始T细胞标志物白细胞介素7受体、LEF1等表达下调(图4)。机制研究发现,淋巴瘤外泌体中富含转化生长因子-β,通过激活Smad3信号通路诱导嵌合抗原受体T细胞向调节性T细胞转化及终末分化。使用转化生长因子-β抑制剂LY2109761可显著逆转上述效应,降低抑制性受体表达,恢复嵌合抗原受体T细胞的细胞毒性和增殖能力(图5)。
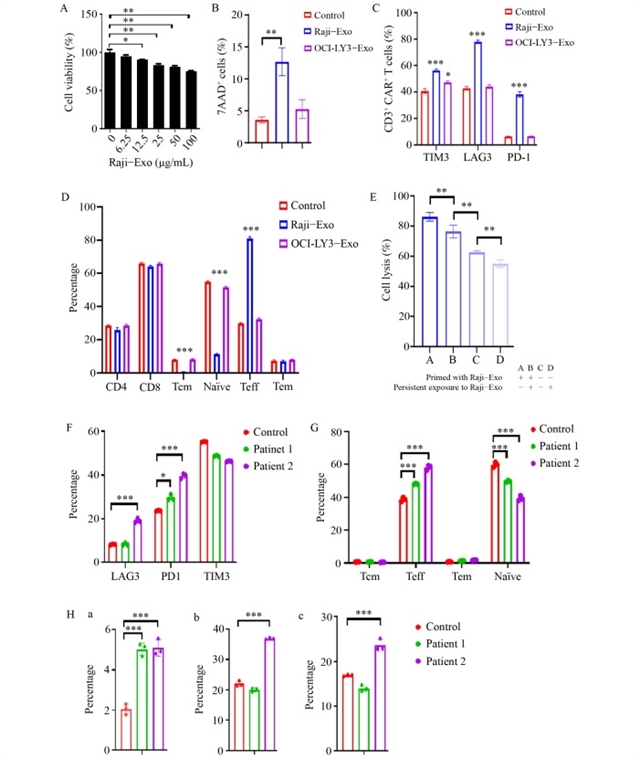
图3 淋巴瘤患者的肿瘤来源外泌体(TEXs)及血浆外泌体可损伤CAR-T细胞的效应功能
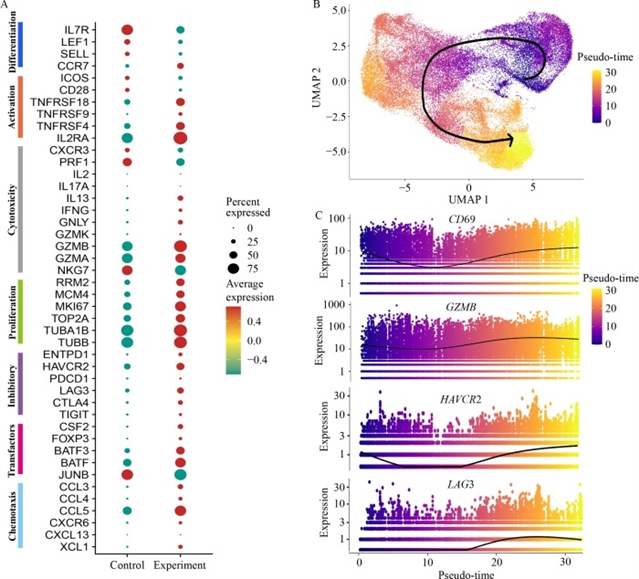
图4 经单细胞转录谱分析Raji细胞外泌体暴露后,CAR-T细胞中与T细胞功能及表型相关的差异表达基因
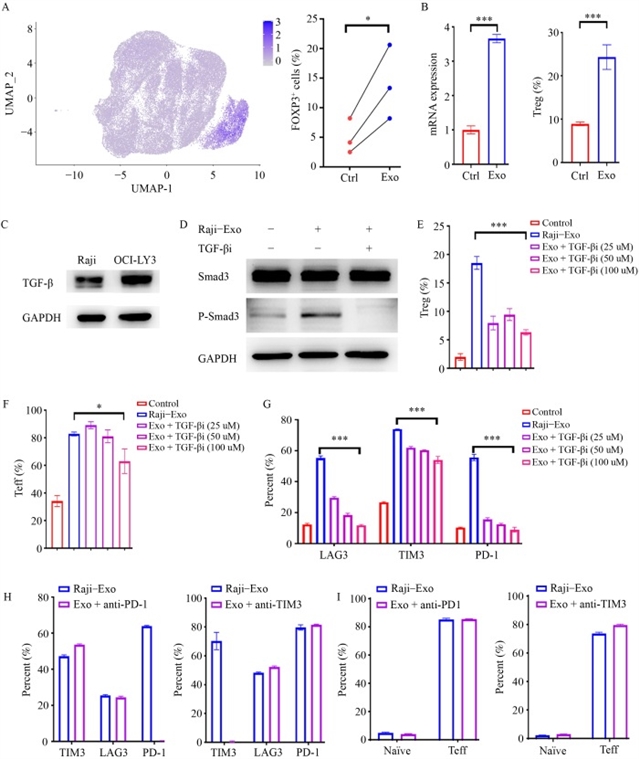
图5 外泌体转化生长因子β可促进CAR-T细胞向调节性T细胞及终末分化表型转化
动物实验进一步验证了联合治疗策略的有效性。在NOD SCID IL-2Rγ−/−(NSG)小鼠淋巴瘤模型中,单独输注嵌合抗原受体T细胞可抑制肿瘤生长,但部分小鼠仍出现肿瘤复发;而联合应用LY2109761(100 mg/kg)可完全清除肿瘤,显著延长小鼠生存期,且未观察到明显毒性反应(图6)。这一结果提示,转化生长因子-β信号通路阻断可能成为增强嵌合抗原受体T细胞疗法疗效的关键靶点。
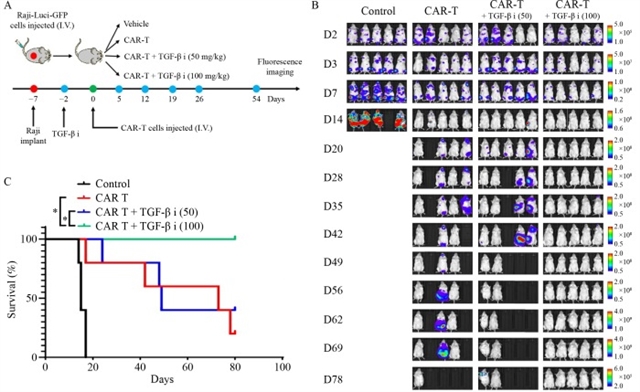
图6 CD19-CAR-T细胞联合TGF-β抑制剂可清除B细胞淋巴瘤
本研究系统揭示了淋巴瘤外泌体对CD19特异性嵌合抗原受体T细胞的双重调控作用:短期暴露通过外泌体CD19抗原激活嵌合抗原受体T细胞,而长期暴露则通过转化生长因子-β-Smad3通路诱导其功能障碍。研究不仅为理解嵌合抗原受体T细胞疗法的耐药机制提供了新视角,还提出了联合转化生长因子-β抑制剂的治疗策略,为改善难治性、复发性B细胞淋巴瘤患者的临床预后提供了实验依据。值得注意的是,研究同时指出不同患者血浆外泌体中转化生长因子-β水平存在异质性,这可能影响临床治疗效果,提示未来需结合患者外泌体特征制定个体化治疗方案。
原文信息
标题
Tumor-derived exosomes induce initial activation by exosomal CD19 antigen but impair the function of CD19-specific CAR T-cells via TGF-β signaling
作者
Yuanyuan Hao1,2, Panpan Chen1, Shanshan Guo1, Mengyuan Li1, Xueli Jin1, Minghuan Zhang1, Wenhai Deng3, Ping Li4, Wen Lei1, Aibin Liang4, Wenbin Qian1
机构
1. Department of Hematology, The Second Affiliated Hospital, College of Medicine, Zhejiang University, Hangzhou 310009, China
2. Department of Hematology, Henan Provincial People’s Hospital; Zhengzhou University People’s Hospital, Zhengzhou 450003, China
3. Key Laboratory of Laboratory Medicine, Ministry of Education, School of Laboratory Medicine and Life Sciences, Wenzhou Medical University, Wenzhou 325000, China
4. Department of Hematology, Tongji Hospital of Tongji University, Shanghai 200065, China
通讯作者
Wen Lei, Aibin Liang, Wenbin Qian
引用这篇文章
Yuanyuan Hao, Panpan Chen, Shanshan Guo, Mengyuan Li, Xueli Jin, Minghuan Zhang, Wenhai Deng, Ping Li, Wen Lei, Aibin Liang, Wenbin Qian. Tumor-derived exosomes induce initial activation by exosomal CD19 antigen but impair the function of CD19-specific CAR T-cells via TGF-β signaling. Front. Med., 2024, 18(1): 128–146
https://doi.org/10.1007/s11684-023-1010-1
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1010-1
https://link.springer.com/article/10.1007/s11684-023-1010-1
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。