复旦大学附属眼耳鼻喉科医院教授黄锦海、周行涛团队,以真核来源、体积极小的“迷你剪刀”Fanzor系统为核心,通过对蛋白与ωRNA进行协同工程化改造,在哺乳动物细胞中实现了基因编辑效率的成倍提升,并首创以Fanzor系统在不产生双链断裂情况下搭建A→G/C→T双向碱基编辑的平台,单腺相关病毒(AAV)一针递送即可获得在眼内清晰编辑信号。相关研究10月9日发表于《分子细胞》。
Fanzor是在真核生物中发现的一类可编程的RNA引导DNA 核酸酶,具有结构紧凑、体积小巧的特点。在基因编辑领域,Fanzor被认为是突破体内递送瓶颈的潜在“利器”,但长期受限于哺乳动物细胞内的编辑活性与稳定性不足的问题。
为攻克此痛点,研究团队采用“蛋白-ωRNA双轮驱动”策略。一方面对RuvC等关键酶活性结构域相关位点突变并进行组合优化,另一方面重构ωRNA骨架茎环与配对区,实现蛋白与RNA改造的协同增效,从而大幅提升编辑系统的整体活性。
由此,研究团队构建得到了新型RNA 引导DNA 内切酶SpuFz1 V4。系统评估表明,SpuFz1 V4在多个人类内源位点编辑效率显著提升,展现出真核来源RNA引导核酸酶中罕见的高活性与良好兼容性。
此外,得益于其小巧的体积,SpuFz1 V4可通过AAV单载体高效递送至视网膜,发现在Ai9报告小鼠模型中可观察到清晰的荧光信号,且在内源位点检测到稳定编辑信号。
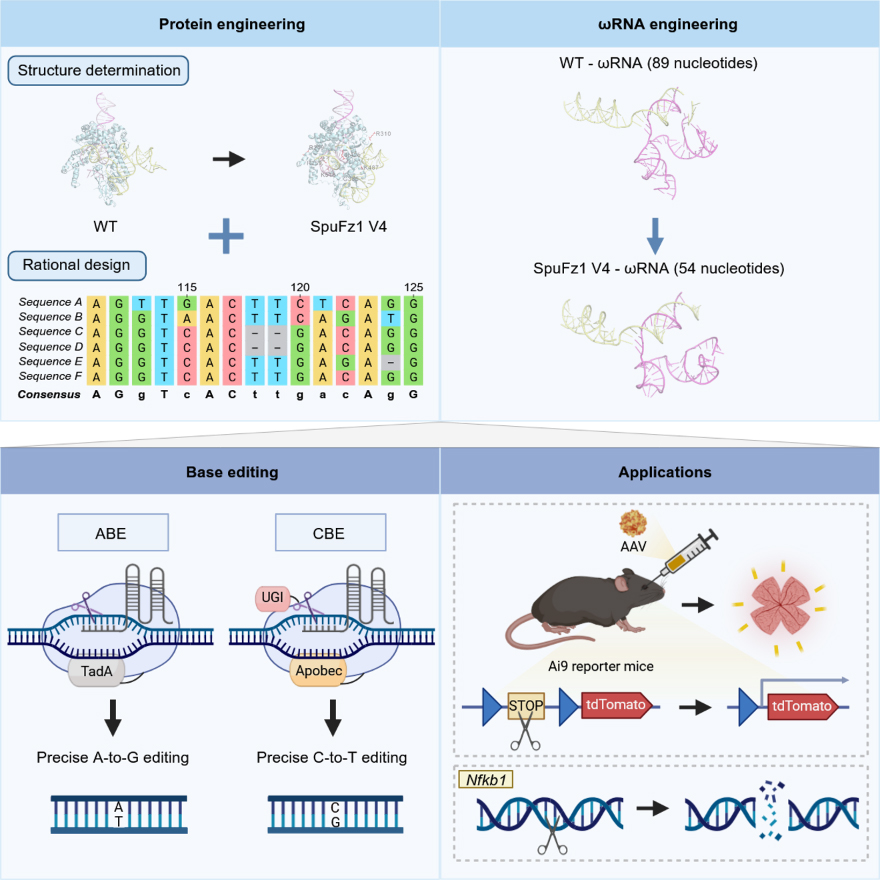 SpuFz1基因编辑平台的工程化与应用。图片由研究团队提供
SpuFz1基因编辑平台的工程化与应用。图片由研究团队提供
?
研究团队表示,该超紧凑编辑工具兼具“装得下、进得去、改得准”的特点,为眼科、神经系统等组织的在体治疗提供了重要方法学支持,推动“单AAV精准体内编辑”走向现实。此外,团队创建的基因编辑平台,可与RNA/LNP递送、个体化靶点筛选及临床影像监测深度融合,构建从靶点挖掘、工具定制,到在体精准干预与安全评估的全流程解决方案,推动遗传性眼病的精准诊疗及眼科在体基因编辑的临床应用。针对角膜新生血管疾病、遗传性视网膜变性等重大眼病,该技术为“一针式”精准干预提供助力,带来更可靠、可复制且高效的治疗方案。
相关论文信息:http://doi.org/10.1016/j.molcel.2025.09.031
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。