导读
黑色素瘤的发病率在全球范围内不断攀升,其转移性强、死亡率高,严重威胁着人类健康。传统的治疗方法包括手术切除、化疗、放疗和免疫疗法,但这些方法在晚期或转移性黑色素瘤患者中的疗效有限,且常伴随严重的副作用。
近年来,光热疗法(Photothermal Therapy,PPT)作为一种新兴的癌症治疗手段,受到广泛关注。光敏剂在光热治疗中发挥着关键作用,它能利用光照在局部产生高温,杀死癌细胞。与传统疗法相比,光热疗法具有微创、精准、副作用小等优势。
金纳米棒,因其独特的光学性质和易于表面化等优点,成为了光热治疗的理想载体。金纳米棒由于局部表面等离子体共振,能够高效吸收近红外光,进行能量转化,同时通过表面修饰实现肿瘤的精准靶向,减少“误伤“正常细胞。目前已有金纳米棒用于临床试验,但金纳米棒在光热治疗中的应用研究仍有空白,系统比较金纳米棒在不同的光照模式下的性能,对于优化光热疗法的临床应用具有重要意义。
为此,俄罗斯ITMO 大学等机构的研究人员开发了一种基于金纳米棒(Au NRs)的靶向光热疗法。通过靶向肽修饰,使纳米棒能特异性地聚集在黑色素瘤细胞周围,实现对肿瘤细胞的精准热消融。此外,该研究团队还比较了飞秒和纳秒脉冲激光在光热治疗中的效果,得出了具有指导意义的结论,有望推动功能性等离子体纳米材料的临床应用。该工作以题为“A comparative study of plasmonic nanoparticles for targeted photothermal therapy of melanoma tumors using various irradiation modes”发表在Light: Advanced Manufacturing。
如图1,研究团队首先合成了金纳米棒,并结合聚乙二醇(PEG),以提高其在生物环境中的稳定性,随后基于这种纳米棒Au@PEG进行实验和理论模拟。
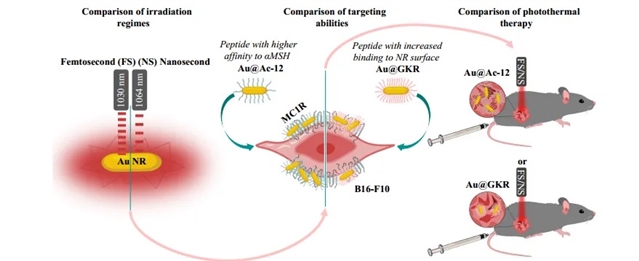
图1:研究思路
如图2和图3所示,研究人员发现,由于电子和声子温度的弛豫速率在周围水中耗散,金纳米棒在飞秒激光照射下能够产生更多的热量,从而达到更高的温度。
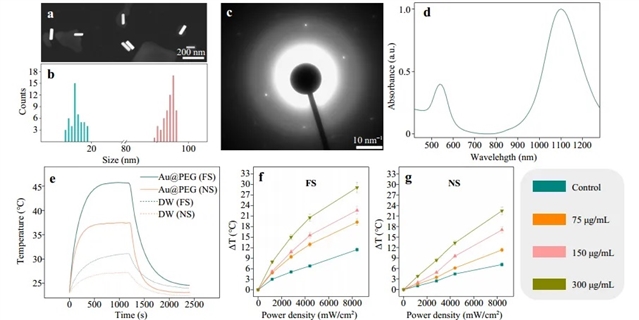
图2:Au@PEG纳米棒性质和体外实验结果a.扫描电子扫描显微镜图像;b.长度和宽度c.X射线衍射图;d.紫外-可见光谱;e.在飞秒(FS)和纳秒(NS)激光照射下,纳米棒(Au@PEG)和水(DW)的温度随时间变化图象;f-e.在飞秒/纳秒激光照射下,不同浓度纳米棒的温度变化量随功率密度的变化图像
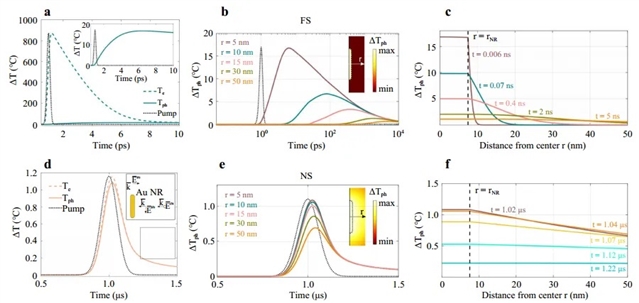
图3:纳米棒Au@PEG温度演变的数值模拟结果
该研究团队还将两种不同类型的肽(Ac-12和GKR)分别修饰到金纳米棒表面,以增强其与黑色素瘤细胞的结合能力,随后利用这两种金纳米棒开展体外细胞和体内实验,如图4至图6所示。研究人员将修饰有Ac-12 和 GKR肽的金纳米棒分别注射到携带黑色素瘤的小鼠体内实验。实验结果显示,飞秒激光照射组的肿瘤体积显著减小,肿瘤生长抑制率最高可达94%,而纳秒激光照射组的抑制效果相对较弱。此外,通过光声成像技术,研究人员观察到修饰有Ac-12 肽的金纳米棒在肿瘤部位的积累率更高。这是因为Ac-12 肽对MC1R 受体具有更高的亲和力,进一步证实了其优越的靶向性能。
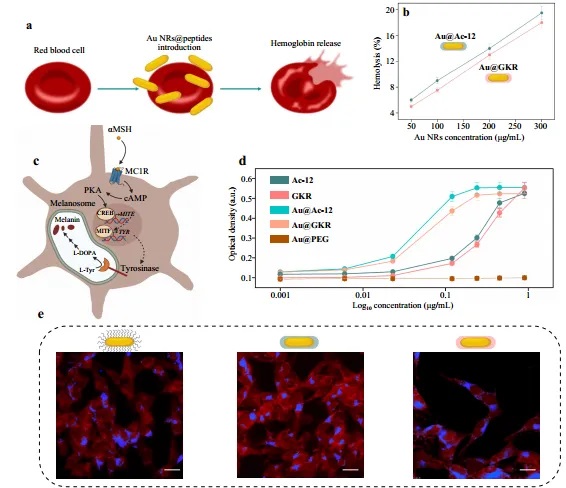
图4:Au NRs与体外细胞的相互作用
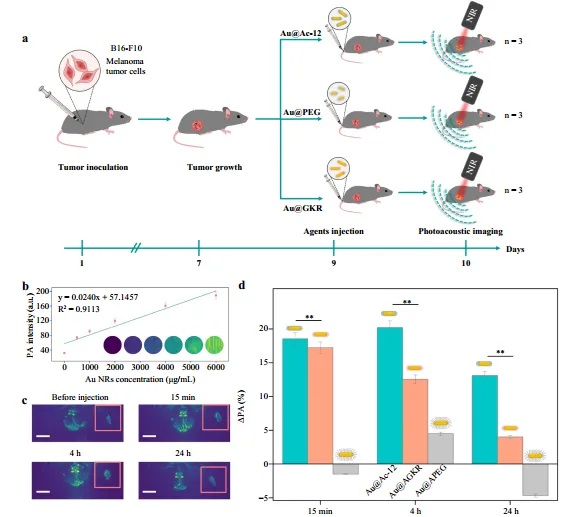
图5:Au NRs的体内光声成像
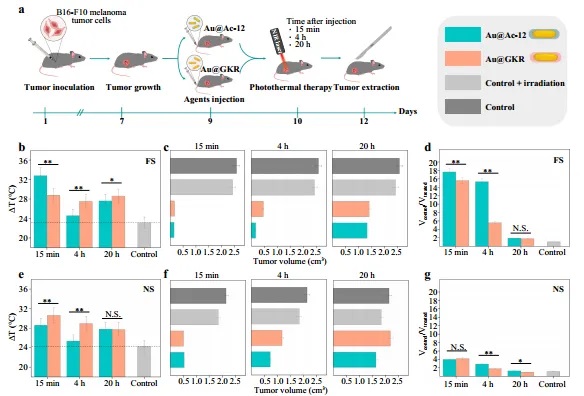
图6:基于Au NRs的光热疗法
该工作系统地研究了金纳米棒的表面修饰、照射模式对光热转换效率和靶向治疗效果的影响,为黑色素瘤的光热疗法提供了重要的理论依据和实践指导。未来,研究人员计划进一步优化金纳米棒的表面修饰和激光照射参数,以提高治疗效果和安全性。同时,他们还将探索这种靶向光热疗法在其他类型肿瘤中的应用潜力。
总之,这项研究的成功为黑色素瘤的精准治疗带来了更多希望,也为纳米技术在医学领域的应用提供了有力的支持。随着技术的不断进步和完善,相信这种创新的治疗方法将在不久的将来走向临床,为人类健康事业做出重要贡献。(来源:先进制造微信公众号)
相关论文信息:https://doi.org/10.37188/lam.2025.005
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。