|
|
|
|
|
FMD | 精彩荐读:BGB-A445是一种新型非配体阻断激动性抗OX40抗体,在临床前模型中展现出优异的免疫激活及抗肿瘤效果 |
|
|
论文标题:BGB-A445, a novel non-ligand-blocking agonistic anti-OX40 antibody, exhibits superior immune activation and antitumor effects in preclinical models
期刊: Frontiers of Medicine
作者:Beibei Jiang, Tong Zhang, Minjuan Deng, Wei Jin, Yuan Hong, Xiaotong Chen, Xin Chen, Jing Wang, Hongjia Hou, Yajuan Gao, Wenfeng Gong, Xing Wang, Haiying Li, Xiaosui Zhou, Yingcai Feng, Bo Zhang, Bin Jiang, Xueping Lu, Lijie Zhang, Yang Li, Weiwei Song, Hanzi Sun, Zuobai Wang, Xiaomin Song, Zhirong Shen, Xuesong Liu, Kang Li, Lai Wang, Ye Liu
发表时间: 15 Dec 2023
DOI:10.1007/s11684-023-0996-8
微信链接:点击此处阅读微信文章
导 读
百济神州(北京)生物科技有限公司刘晔等在Frontiers of Medicine发表研究论文《BGB-A445是一种新型非配体阻断激动性抗OX40抗体,在临床前模型中展现出优异的免疫激活及抗肿瘤效果》(BGB-A445, a novel non-ligand-blocking agonistic anti-OX40 antibody, exhibits superior immune activation and antitumor effects in preclinical models)。本研究开发了一种新型非OX40L竞争性激动性抗OX40抗体BGB-A445,通过体外实验、结构解析及体内模型验证了其具有更优的免疫激活和剂量依赖性抗肿瘤效果,并与抗PD-1抗体联用时显示出协同潜力。
OX40是一种主要表达于激活的CD4+、CD8+效应T细胞和调节性T细胞表面的共刺激受体,其与唯一配体OX40L结合后,能通过激活NF-κB信号通路促进T细胞增殖、分化及功能发挥,同时还能诱导树突状细胞成熟并增强其细胞因子分泌能力。因此,通过激动性抗OX40抗体激活OX40信号通路,成为癌症免疫治疗的重要探索方向。然而,目前进入临床试验的激动性抗OX40抗体多为OX40L竞争性抗体,这类抗体在阻断OX40与OX40L结合的同时,可能限制了树突状细胞的功能及T细胞的充分激活,导致临床疗效有限。
基于此,百济神州(北京)生物科技有限公司刘晔等开展了一项研究,开发了一种不阻断OX40-OX40L相互作用的新型激动性抗OX40抗体——BGB-A445,并验证了其免疫激活及抗肿瘤潜力。相关研究发表在Frontiers of Medicine。
研究团队首先通过杂交瘤技术筛选出能与OX40高亲和力结合的抗体克隆,进一步通过流式细胞术和表面等离子体共振(SPR)分析排除结合力弱的克隆,再利用T细胞共刺激实验评估激动活性,最终获得唯一不阻断OX40-OX40L相互作用的克隆445,经人源化优化后命名为BGB-A445。流式细胞术检测显示,BGB-A445能以剂量依赖性方式与过表达OX40的HuT78细胞及人原代CD4+ T细胞结合,且不影响OX40与OX40L的结合(图1)。
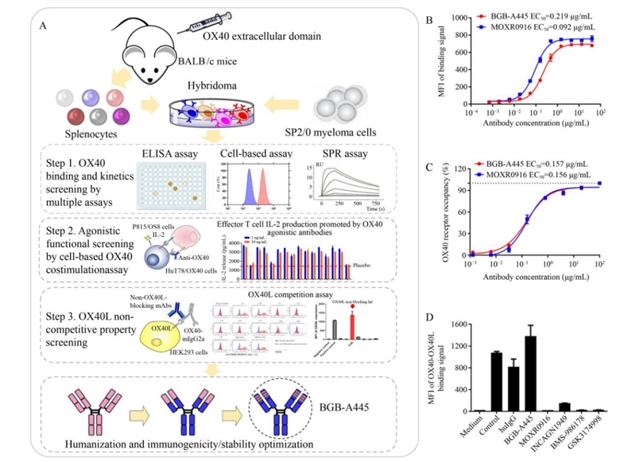
图1 BGB-A445与OX40高效结合且不干扰OX40-OX40L相互作用
为明确其非竞争性机制,团队解析了OX40与BGB-A445 Fab段的共晶结构(分辨率2.55Å),发现BGB-A445通过互补决定区与OX40的第四半胱氨酸富集区(CRD4)结合,而OX40L主要结合OX40的CRD1-3区,两者结合界面无重叠(图2),这从结构层面解释了BGB-A445不阻断OX40-OX40L相互作用的特性。
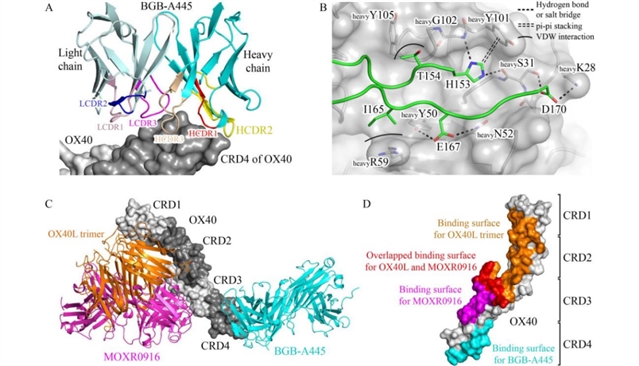
图2 OX40与BGB-A445 Fab段复合物的晶体结构进一步证实BGB-A445与OX40L的非竞争性
体外功能验证中,BGB-A445在T细胞-树突状细胞共培养体系中表现出显著优势:其能剂量依赖性地促进CD4+ T细胞分泌IL-2,而OX40L竞争性抗体MOXR0916在高浓度时出现“钩状效应”,IL-2分泌减少;同时,BGB-A445能更有效地诱导树突状细胞表面CD83、CD86等成熟标志物的表达(图3),提示其在激活T细胞的同时保留了树突状细胞的功能。体内实验中,在人源化OX40敲入小鼠的MC38结肠癌模型中,BGB-A445呈剂量依赖性地增加脾脏中增殖性效应T细胞及记忆表型T细胞的数量(图4),而MOXR0916在高剂量时未进一步增强T细胞激活。此外,BGB-A445通过抗体依赖性细胞毒性(ADCC)优先耗竭肿瘤浸润调节性T细胞(Treg),显著提高了肿瘤内CD8+ T细胞与Treg的比值(图5),而MOXR0916的Treg耗竭效果较弱。
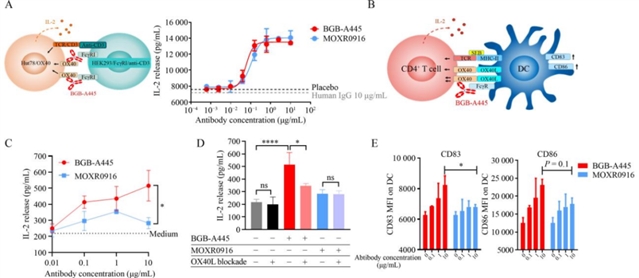
图3 BGB-A445诱导最佳T细胞激活及树突状细胞成熟
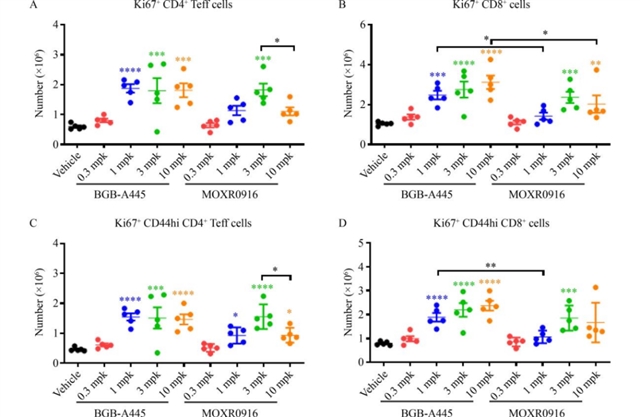
图4 BGB-A445在荷MC38肿瘤的人源化OX40敲入小鼠中剂量依赖性增加增殖及激活的效应T细胞数量
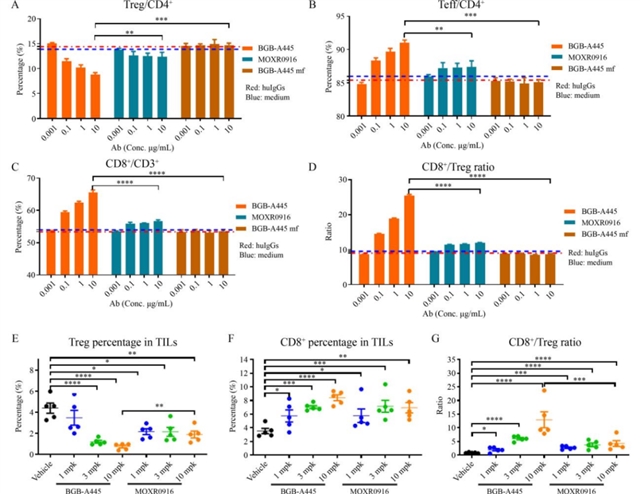
图5 BGB-A445在体外及体内优先耗竭调节性T细胞并提高CD8+ T细胞与调节性T细胞比值
抗肿瘤疗效方面,BGB-A445在MC38模型中表现出剂量依赖性的肿瘤生长抑制(TGI),2 mg/kg和10 mg/kg剂量组的TGI分别达80%和78%,而MOXR0916在2 mg/kg时TGI为60%,10 mg/kg时TGI反而下降;在PD-1抑制剂耐药的PAN02模型中,BGB-A445单药TGI达75%,显著优于MOXR0916的41%(图6)。进一步研究发现,BGB-A445与抗PD-1抗体联用能协同抑制MC38肿瘤生长,联合治疗组TGI达78%(图7),显示出良好的协同潜力。
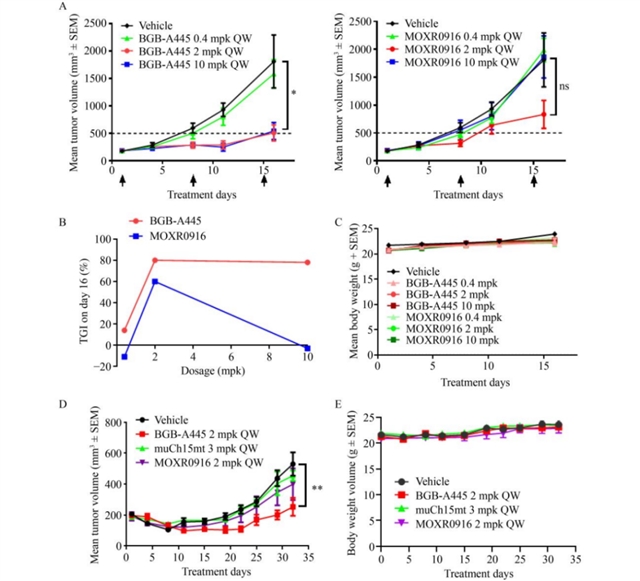
图6 BGB-A445在MC38同基因肿瘤模型中发挥剂量依赖性抗肿瘤活性,并在PD-1耐药模型PAN02中展现更优疗效
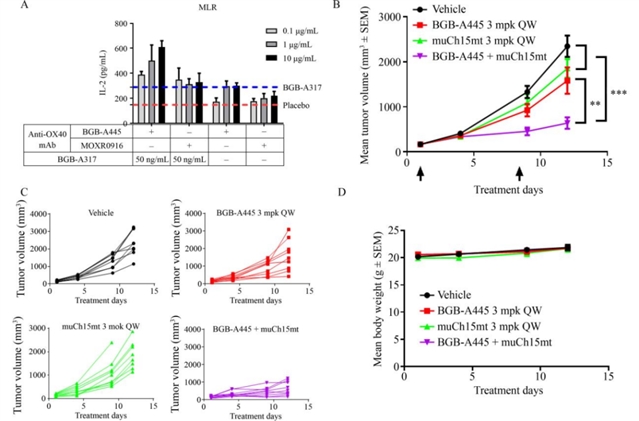
图7 BGB-A445与抗PD-1抗体联用时发挥联合效应
本研究系统验证了非OX40L竞争性抗OX40抗体的优势,BGB-A445通过避免阻断OX40-OX40L相互作用,在激活T细胞的同时保留了树突状细胞的功能,从而实现了更高效的免疫激活及剂量依赖性抗肿瘤效果。其与PD-1抑制剂的协同作用,为解决部分肿瘤对PD-1抑制剂耐药的问题提供了新策略。目前,BGB-A445的Ⅰ期临床试验正在开展,旨在评估其作为单药及与替雷利珠单抗联用在晚期实体瘤患者中的安全性和初步疗效,为后续临床应用奠定了重要基础。
原文信息
标题
BGB-A445, a novel non-ligand-blocking agonistic anti-OX40 antibody, exhibits superior immune activation and antitumor effects in preclinical models
作者
Beibei Jiang1, Tong Zhang1, Minjuan Deng2, Wei Jin2, Yuan Hong1, Xiaotong Chen1, Xin Chen1, Jing Wang1, Hongjia Hou1, Yajuan Gao1, Wenfeng Gong1, Xing Wang1, Haiying Li1, Xiaosui Zhou1, Yingcai Feng1, Bo Zhang1, Bin Jiang2, Xueping Lu2, Lijie Zhang2, Yang Li2, Weiwei Song2, Hanzi Sun1, Zuobai Wang3, Xiaomin Song1, Zhirong Shen2, Xuesong Liu1, Kang Li4, Lai Wang1, Ye Liu1
机构
1. Department of Biology
2. Department of Discovery Biomarkers
3. Department of Clinic Development
4. Department of Biologics, BeiGene (Beijing) Co., Ltd., Beijing 102206, China
通讯作者
Ye Liu
引用这篇文章
Beibei Jiang, Tong Zhang, Minjuan Deng, Wei Jin, Yuan Hong, Xiaotong Chen, Xin Chen, Jing Wang, Hongjia Hou, Yajuan Gao, Wenfeng Gong, Xing Wang, Haiying Li, Xiaosui Zhou, Yingcai Feng, Bo Zhang, Bin Jiang, Xueping Lu, Lijie Zhang, Yang Li, Weiwei Song, Hanzi Sun, Zuobai Wang, Xiaomin Song, Zhirong Shen, Xuesong Liu, Kang Li, Lai Wang, Ye Liu. BGB-A445, a novel non-ligand-blocking agonistic anti-OX40 antibody, exhibits superior immune activation and antitumor effects in preclinical models. Front. Med., 2023, 17(6): 1170–1185
https://doi.org/10.1007/s11684-023-0996-8
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-0996-8
https://link.springer.com/article/10.1007/s11684-023-0996-8
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。