|
|
|
|
|
用扩环[5,5]-异位重排反应合成高张力对环番骨架 |
|
|
对环番骨架广泛存在于天然产物和生物活性分子中,但通过传统闭环策略或其它方法合成高度张力的对环番仍然面临诸多挑战。近日,重庆大学李杨教授与河南师范大学陈豪华副研究员等人报道了一种环状叔胺与芳炔之间的N-芳基化/扩环[5,5]-σ重排的新方法。该合成策略不仅克服了传统环闭合成策略的局限性,还能够高效地合成具有独特立体化学特征的对环番骨架。2025年7月21日,相关成果以“Synthesis of highly strained para-cyclophanes via ring-expansion [5,5]-sigmatropic rearrangement reaction”为题发表在Nature Chemistry期刊上。
对环番骨架是一类独特的含1,4-二取代苯环的大环化合物,常见于万古霉素等天然产物及具有生物活性的分子中(图1)。传统闭环合成方法在构筑高张力对环番时面临诸多挑战,包括需要高稀释条件、易发生分子间二聚或聚合副反应,以及难以精确调控环张力。本研究创新性提出环状叔胺与苯炔中间体的N-芳基化/环扩张[5,5]-σ重排反应,并用于高效合成高张力对环番骨架的新方法。晶体结构分析表明,产物苯环的弯曲角度可达30.6°,其张力能与天然产物相当。该方法展现了出色的底物通用性和立体选择性,为药物化学研究提供了新颖的三维分子工具。
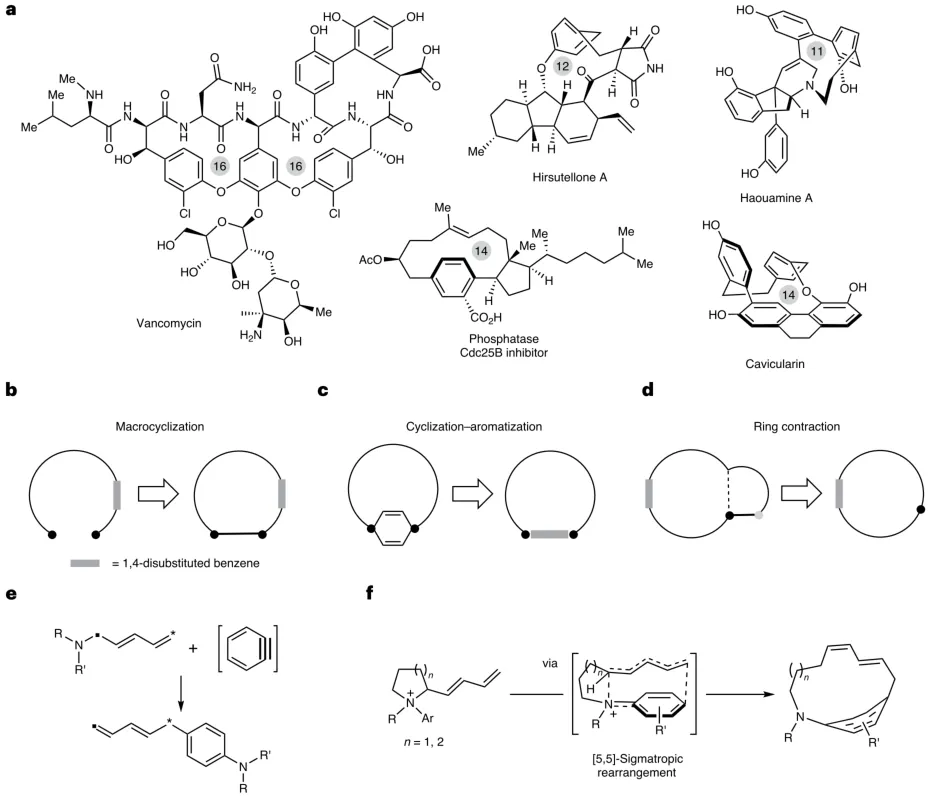
图1:背景和本文的策略。
图2 揭示了关键反应条件的优化过程。在乙腈溶剂中,以CsF为氟源、50℃反应5小时,模型底物1a与苯炔前体2a反应可获得75%收率的对环番3a(图2a)。单晶衍射显示其苯环呈现显著弯曲。StrainViz分析表明最大张力能(17.7 kcal mol-1)集中于弯曲苯环左侧的C-C单键(图2d)。
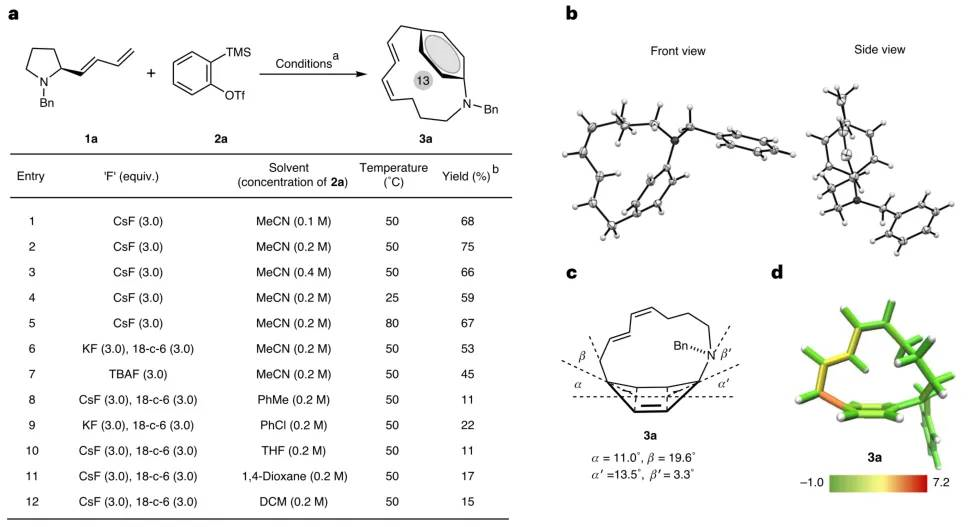
图2:对环番3a的制备及张力分析。
在最优的反应条件下,研究团队对底物范围进行了广泛的探索。结果显示,多种环状三级胺和苯炔前体均能顺利参与反应并生成相应的对环番产物,展示了广泛的底物适应性(表1)。
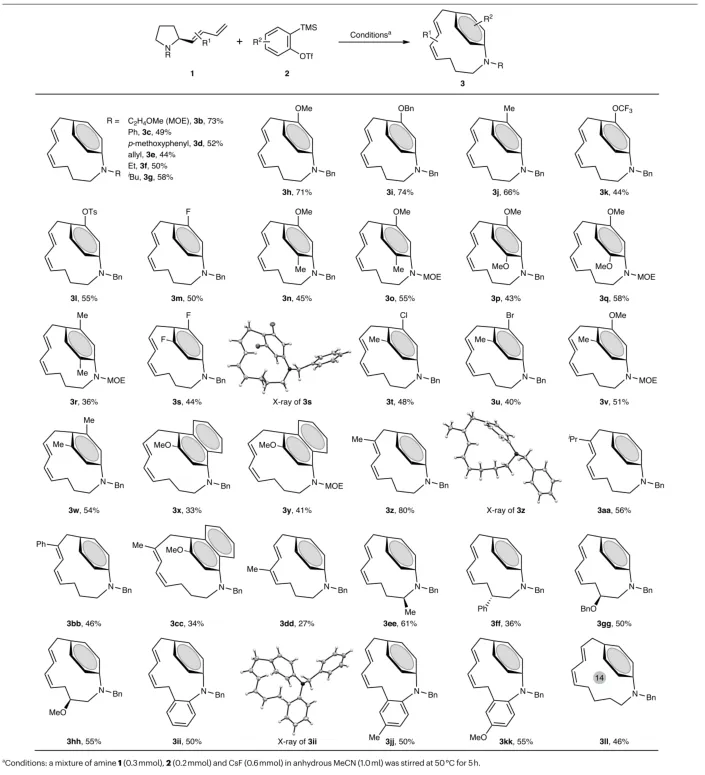
表1:对环番的底物范围。
当底物4含锚定亲电基团时,通过N-芳基化-环化-[5,5]-σ重排级联反应,实现了包含三级醇手性中心与平面手性单一异构体的一步构筑(表2)。

表2:N-芳基化-环化-扩环反应的底物范围。
图3 阐明了取代基对反应路径的调控机制。当1,3-二烯C1位含甲基取代时(6a-b),因空间位阻导致[3,3]-σ重排优先发生,生成九元环产物7a-b(图3a);而使用C3位甲基取代底物6c则触发非常规[5,5]-重排模式,生成二烯构型翻转的产物8a-b(图3b)。通过11个晶体结构对比发现:二氟取代(3s)或邻位二取代苯环(3ii)的张力能可提升至20.8 kcal/mol。
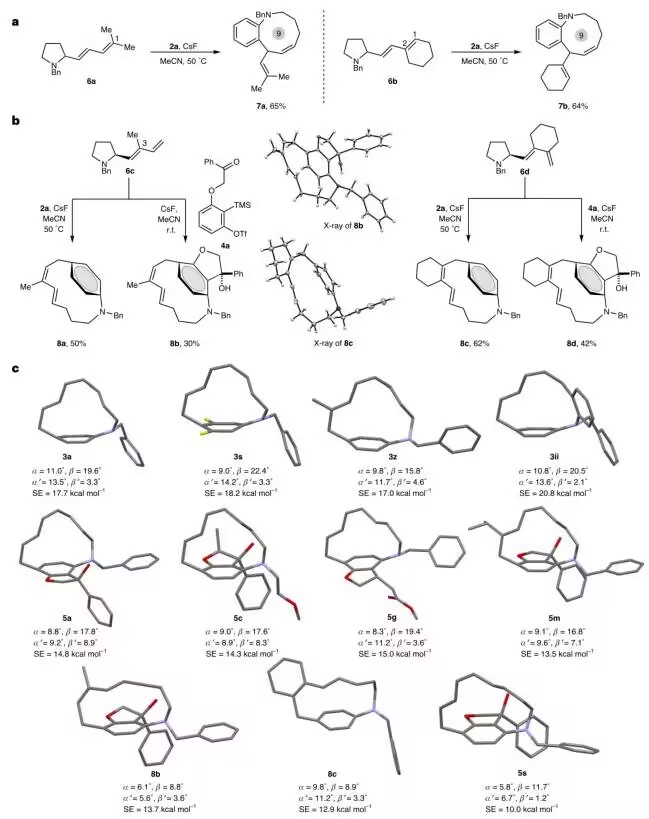
图3:取代基效应及环张力研究。
为揭示中心手性到平面手性的传递规律,作者以93% ee的手性吡咯烷1a为原料,在-30℃低温条件下,萘炔产物3x具有83% ee(图4a),而环化重排产物5l高达85% ee(图4b)。通过在C2位引入位取代基(如5m, 5n)来限制重排过渡态构象,可进一步提升对映选择性至87-89%。研究证明吡咯烷骨架取代基位置对中心手性到面手性转移效率具有显著影响。
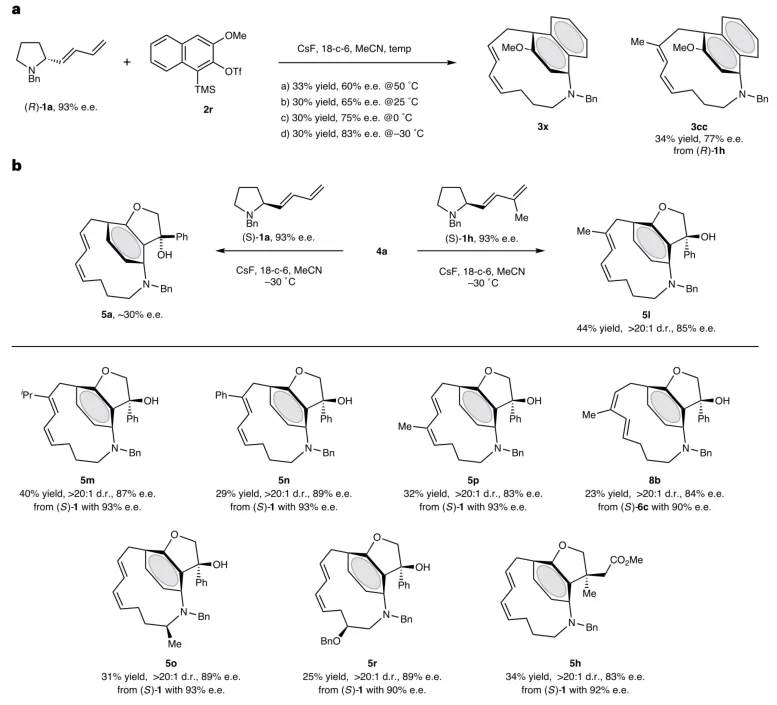
图4:中心手性到平面手性的传递规律研究。
为了深入了解反应机理,研究团队进行了密度泛函理论(DFT)计算(图5)。计算结果表明,反应的对映选择性和中心到平面手性传递过程主要受氢键相互作用以及位阻效应共同影响。
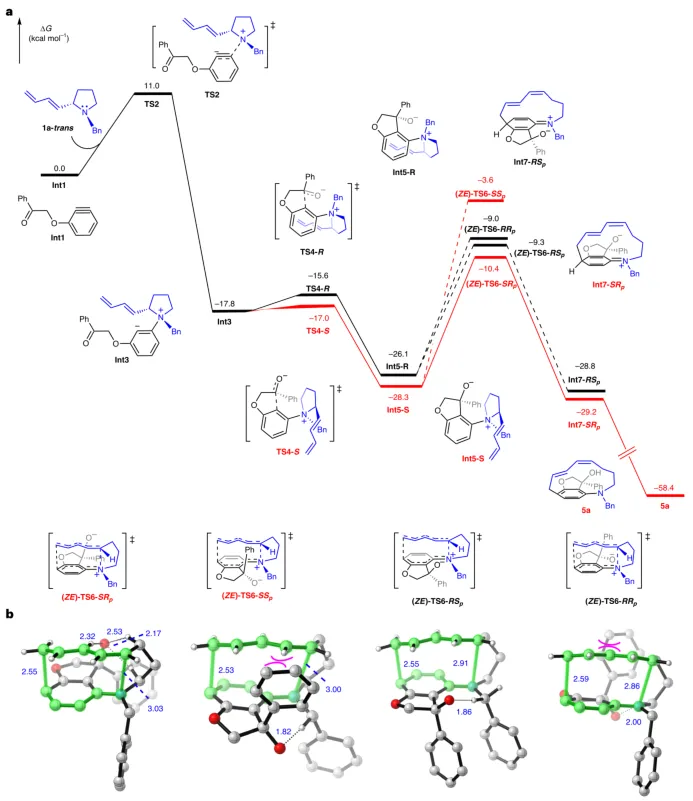
图5:DFT计算。
该研究不仅为合成化学领域提供了新的工具,也为对环番化合物在药物化学和材料科学中的应用提供了新的可能性。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-025-01878-w