近日,上海交通大学朱晨教授团队提出了通过自由基均裂取代与Pummerer重排的组合策略,通过外加自由基对炔丙基N-叔丁基亚磺酰胺的加成引发分子内均裂取代反应(SHi),反应过程展现出优异的对映专一性。所得环状手性亚磺酰胺在后续Pummerer重排中实现中心手性到轴手性的转移,从而对映选择性地构建含异噻唑的轴手性联芳基化合物。该方法为5,6-及5,5-联芳骨架的多样化合成提供了通用策略。
2025年5月19日,相关成果以“Central-to-Axial Chirality Transfer to Construct Atropisomeric Isothiazoles”为题发表在Chem期刊上。上海交通大学朱晨教授为论文通讯作者。上海交通大学博士研究生陈亚苏和中国科学院上海有机所博士后王桐坤为论文共同第一作者。
轴手性化合物在天然产物和药物中广泛存在,也作为手性配体和催化剂在不对称合成中起着重要作用,近些年来备受关注。虽然联萘和联苯骨架的轴手性合成已取得重大进展,但含杂芳基轴手性的构建方法仍相对匮乏。在轴手性骨架中引入杂原子不仅能赋予独特的生物活性,还能提供金属配位位点,从而增强对催化反应性的调控。与吡啶、喹啉等六元杂环相比,五元杂芳基轴手性分子的合成更具挑战性(图1a),主要是因为(杂)芳基取代基间空间距离增大,显著降低旋转能垒并削弱构象稳定性。
另一方面,异噻唑衍生物因其独特的抗病毒、抗糖尿病、抗肿瘤及抗精神疾病等潜在生理活性(图1b),在药物化学中受到不少关注。将轴手性引入平面杂芳环体系可直接构建三维杂芳环骨架,有望提升药物效力和选择性。尽管异噻唑衍生物的合成已有较多报道,但其轴手性衍生物的对映选择性合成仍属空白。
上海交通大学朱晨教授团队提出了通过自由基均裂取代与Pummerer重排的组合策略解决这一难题(图1c)。该策略通过外加自由基对炔丙基N-叔丁基亚磺酰胺的加成引发分子内均裂取代反应(SHi),反应过程展现出优异的对映专一性。所得环状手性亚磺酰胺在后续Pummerer重排中实现中心手性到轴手性的转移,从而对映选择性地构建含异噻唑的轴手性联芳基化合物。该方法为5,6-及5,5-联芳骨架的多样化合成提供了通用策略。
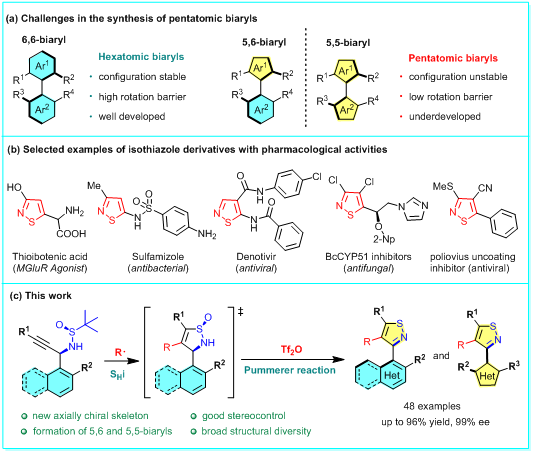
图1: (a) 五元联芳基化合物合成面临的挑战。(b) 具有药理活性的异噻唑衍生物代表性实例。(c) 该工作:通过自由基均裂取代与Pummerer反应实现轴手性异噻唑衍生物的对映选择性合成。
通过详细的底物范围考察,表明该反应对富电性和缺电性的苯磺酰氯均有较好的适用性,可兼容溴、氰基、酯基、酮基和酰胺等多种官能团,且适用于多种杂芳基磺酰氯,如吡唑基、异噁唑基、噻吩基、吡啶基、苯并呋喃基、苯并噻唑基、苯并噻二唑基、喹啉基、香豆素基和二苯并呋喃基,均能以良好收率顺利获得相应产物(图2)。
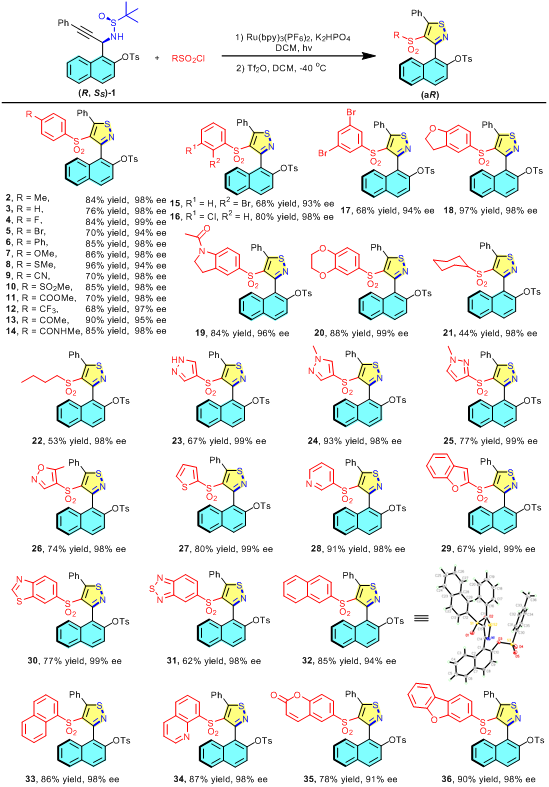
图2:官能团适用性考察。
该方法能够多样性地高效构建多种轴手性异噻唑衍生物(图3)。例如,将萘基替换为苯基、嘧啶基、吡啶基或喹啉基,成功构建了一系列新型5,6-联芳基化合物。引入苯并呋喃基团后,可获得构象稳定的5,5-双杂芳基骨架。此外,该方法还实现了含轴手性异噻唑的烯烃化合物的合成。该方法在复杂分子后期修饰中同样展现出优势,以抗癌药物厄洛替尼的衍生化反应为例,成功实现了其结构修饰。
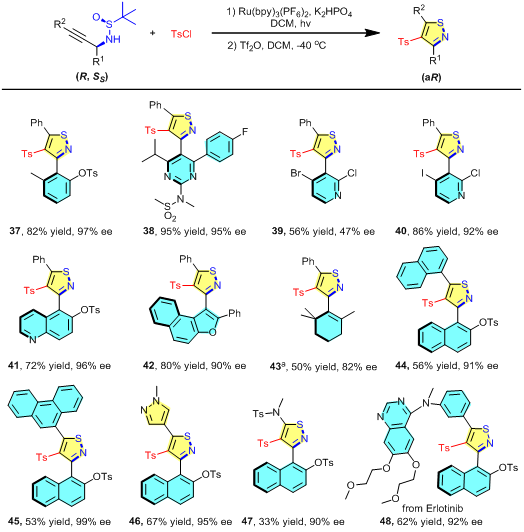
图3:产物结构多样性考察。
该合成方法能实现克级制备(图4a)。此外,开发了一种新颖的基于异噻唑的轴手性N, P-配体,并成功应用于钯催化对映选择性烯丙基烷基化反应和吲哚化反应(图4b),凸显了轴手性异噻唑骨架在不对称合成中的应用潜力。
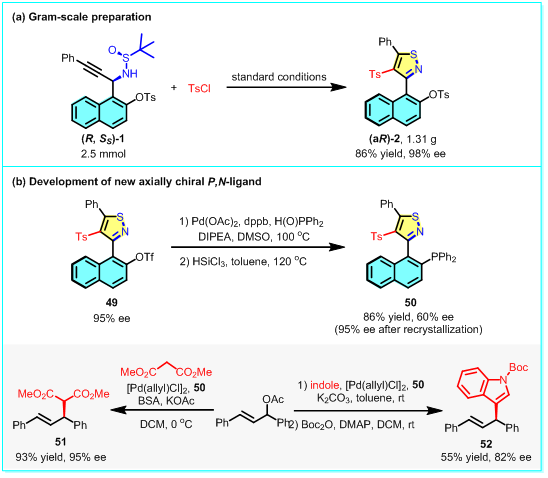
图4:放大反应和新型N, P-配体的合成与应用。
基于系统性的自由基捕获实验、开关灯实验、UV-Vis实验、荧光量子产率测定以及密度泛函理论(DFT)计算的研究提出了合理的反应机理(图5)。
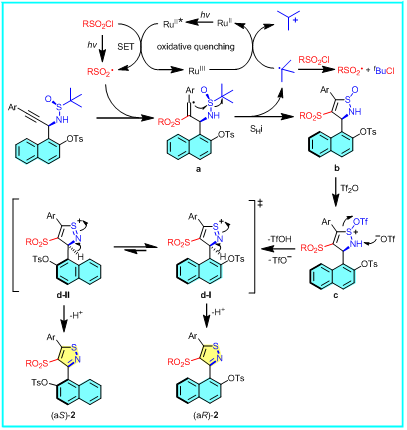
图5:可能的反应机理。
综上所述,该研究首次报道了通过自由基均裂取代反应与Pummerer重排的串联策略,实现了轴手性异噻唑阻转异构体的对映选择性合成。该方法展现出优异的官能团兼容性,可多样化构建具有5,6- 及5,5-联芳基结构的轴手性骨架。通过将产物转化为新型轴手性P, N-配体,该方法的应用价值得到进一步彰显——该配体在钯催化不对称烯丙基烷基化及吲哚化反应中均表现出卓越的催化性能。反应过程中“中心手性到轴手性转移”展现出精准的立体化学控制,为轴手性分子的高效合成提供了新思路。
该研究得到了国家自然科学基金(22371185、22171201),中央高校基本科研业务费专项资金(23X010301599、24X010301678),上海市学术/技术带头人计划(23XD1421900),中国博士后科学基金面上资助(C类)(GZC20241832)的资助。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2025.102592