|
|
|
|
|
P&C 牛津大学Siim Pauklin团队揭示SMAD23-SMYD2与发育转录因子协同细胞周期抑制剂指导组织形成 |
|
|
论文标题:SMAD2/3-SMYD2 and developmental transcription factors cooperate with cell-cycle inhibitors to guide tissue formation
期刊:Protein & Cell
作者:Stefania Militi, Reshma Nibhani, Martin Pook, Siim Pauklin
发表时间:15 Apr 2025
DOI: 10.1093/procel/pwae031
微信链接:点击此处阅读微信文章
牛津大学Siim Pauklin团队在Protein & Cell杂志在线发表了题为“SMAD2/3-SMYD2 and developmental transcription factors cooperate with cell-cycle inhibitors to guide tissue formation”的研究论文。该研究探讨了人类多能干细胞(hPSC)从自我更新到分化转变的分子机制。
AI视频导读
研究的关键发现包括:
1. 分化过程中的CDKI调控:hPSC多能状态下CDKI几乎不存在,但在分化为胚层时高度诱导。内胚层分化特点是G1期显著延长,p15、p18和p57等CDKI表达升高。这些抑制剂在谱系标志物出现前即被诱导,表明其在启动分化中的关键作用。
2. 多能性与分化的表观遗传调控:筛选表观遗传调控因子发现EZH2和SMYD2是关键因子。EZH2抑制可减少多能性标志物,促进分化;SMYD2抑制则阻断CDKI和内胚层标志物诱导。染色质免疫沉淀分析显示,EZH2在多能细胞中对CDKI位点建立抑制性标记(H3K27me3),而SMYD2在分化期间沉积激活性标记(H3K4me3)。
3. SMAD2/3在维持和转换细胞状态中的作用:在hPSC多能状态下,SMAD2/3与OCT4、NANOG、EZH2和SNON相互作用,通过染色质调控抑制CDKI表达。分化期间,SMAD2/3转而与EOMES和SMYD2结合,导致CDKI激活,促进内胚层形成。这一动态转换对从自我更新到谱系特化的进展至关重要。
4. CDKI的谱系特异性功能:功能研究表明CDKI在谱系决定中的重要性。p15、p18和p57敲低损害内胚层和中胚层分化,但增强神经外胚层命运。相反,p21敲低促进内胚层分化,同时抑制神经外胚层和中胚层形成。
本研究阐明了hPSC中CDKI表达如何将细胞周期控制与分化联系起来。SMAD2/3与特定环境下的伙伴(OCT4-NANOG或EOMES-SMYD2)合作,动态调控CDKI位点。这些发现为组织形成的自主调控回路提供了见解,为再生医学和疾病建模提供了潜在策略。
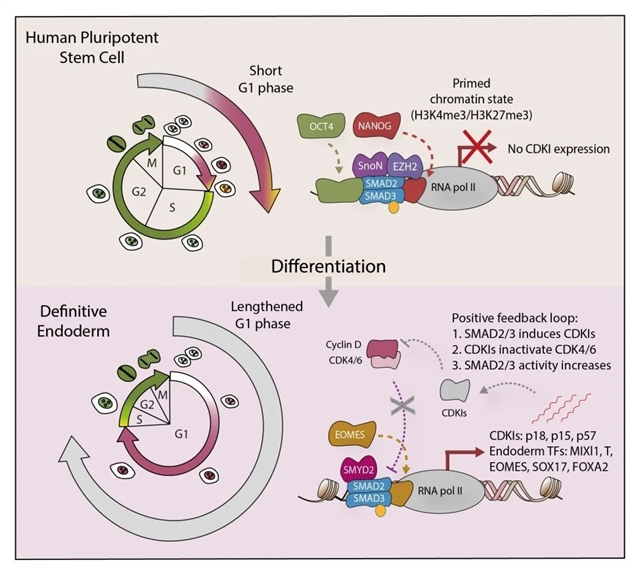
图示:在自我更新的hPSC(人类多能干细胞)中,TGFβ/ACTIVIN-SMAD2/3-EZH2与OCT4和NANOG协同作用,使CDKI(细胞周期依赖性激酶抑制剂)维持于表观遗传上的静息状态,以便快速激活。在内胚层分化启动时,SMAD2/3转而与SMYD2和EOMES结合,诱导CDKI表达,通过抑制CDK(细胞周期依赖性激酶)来指导组织形成。
本研究探讨了人类多能干细胞(hPSC)从自我更新到分化转变的分子机制。研究发现,这一过程由细胞周期依赖性激酶抑制剂(CDKI)与涉及SMAD2/3、SMYD2和发育调节因子(如EOMES)的转录复合物之间的相互作用共同调控。研究结果揭示了细胞命运决定与细胞周期动力学的联系,并为治疗性细胞生产提供了潜在应用。

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。