|
|
|
|
|
FMD | 精彩荐读:免疫景观与基于溶瘤病毒的免疫治疗应答 |
|
|
论文标题:Immune landscape and response to oncolytic virus-based immunotherapy
期刊: Frontiers of Medicine
作者:Chaolong Lin, Wenzhong Teng, Yang Tian, Shaopeng Li, Ningshao Xia, Chenghao Huang
发表时间:15 Jun 2024
DOI:10.1007/s11684-023-1048-0
微信链接:点击此处阅读微信文章
导 读
厦门大学公共卫生学院黄承浩、夏宁邵等在Frontiers of Medicine发表综述《免疫景观与基于溶瘤病毒的免疫治疗应答》(Immune landscape and response to oncolytic virus-based immunotherapy)。本综述探讨了溶瘤病毒(OV)免疫疗法作为癌症治疗策略的潜力,阐述其通过调节肿瘤微环境的免疫景观、靶向特定免疫细胞及联合治疗策略来克服免疫抵抗、增强抗肿瘤免疫反应的机制,并总结了当前研究进展与未来前景。
在癌症治疗领域,溶瘤病毒(OV)免疫疗法作为一种新兴策略,通过利用天然或基因工程改造的病毒选择性感染并裂解肿瘤细胞,同时激发全身抗肿瘤免疫反应,展现出独特的应用潜力。目前,多种溶瘤病毒如新城疫病毒(NDV)、呼肠孤病毒、腺病毒(ADV)和水疱性口炎病毒(VSV)等已进入临床前或临床试验阶段。然而,肿瘤微环境(TME)的免疫抑制性是制约溶瘤病毒疗效的关键障碍。肿瘤微环境由肿瘤细胞、癌症干细胞、内皮细胞、肿瘤相关成纤维细胞(CAFs)及细胞外基质(ECM)等组成,其特征包括酸性环境、缺氧、免疫原性低及免疫细胞功能障碍。其中,调节性T细胞(Tregs)、髓系抑制性细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs)等抑制性免疫细胞的浸润,以及PD-1/PD-L1等免疫检查点分子的高表达,共同构成了“冷肿瘤”微环境,导致T细胞浸润不足、免疫应答受限。因此,如何通过溶瘤病毒重塑肿瘤微环境的免疫景观,克服免疫抵抗,成为当前研究的核心问题。
厦门大学公共卫生学院黄承浩、夏宁邵等通过梳理近年来的临床前和临床研究,总结了溶瘤病毒如何靶向特定免疫细胞、抑制血管生成、减少肿瘤纤维化,进而优化药物递送和治疗效率,为该领域的发展提供了全面视角。
溶瘤病毒的抗肿瘤作用是多维度的。首先,病毒感染肿瘤细胞后可直接导致细胞裂解,并通过诱导免疫原性细胞死亡(ICD)释放肿瘤相关抗原(TAAs)和损伤相关分子模式(DAMPs),如细胞表面钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)、三磷酸腺苷(ATP)和热休克蛋白(HSPs)等。这些分子与靶细胞表面的模式识别受体(PRRs)结合,激活炎症信号通路,促进免疫细胞的招募和活化(图1)。例如,钙网蛋白作为“吞噬我”信号可增强树突状细胞(DCs)的吞噬功能,高迁移率族蛋白B1则驱动促炎信号,共同启动先天免疫应答。
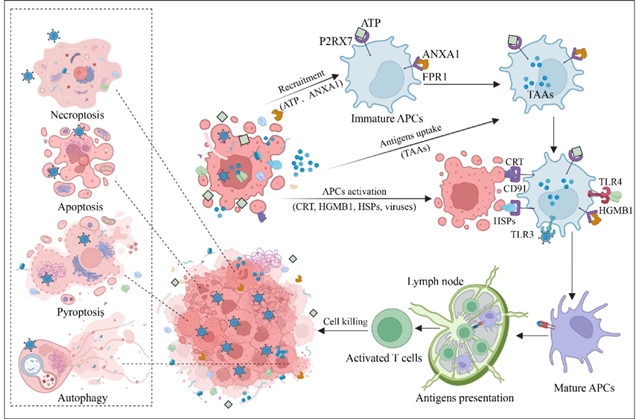
图1 溶瘤病毒诱导多模式免疫原性细胞死亡并引发抗肿瘤免疫反应
在先天免疫激活的基础上,溶瘤病毒进一步调控适应性免疫。感染后,树突状细胞在肿瘤相关抗原和相关分子模式的共同刺激下成熟,高表达CD80、CD86等共刺激分子及主要组织相容性复合体(MHC)Ⅱ类分子,随后迁移至引流淋巴结并将抗原呈递给T细胞,启动T细胞活化。活化的T细胞通过病毒诱导的Ⅰ型干扰素等细胞因子募集至肿瘤部位,同时病毒可上调肿瘤细胞表面MHCⅠ类分子表达,增强T细胞对肿瘤细胞的识别和杀伤。例如,敲除ICP47基因的HSV毒株可显著提升肿瘤细胞MHCⅠ表达,促进效应T细胞的识别(图2)。
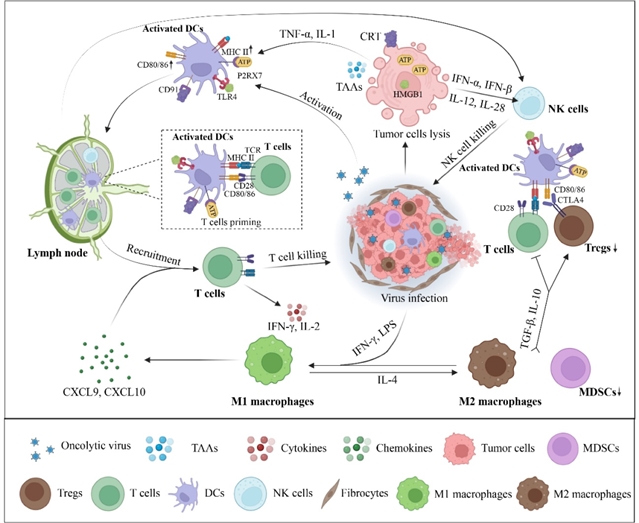
图2 溶瘤病毒多维度重塑肿瘤微环境
针对肿瘤微环境中的抑制性成分,溶瘤病毒通过多种机制重塑免疫景观。在免疫细胞调节方面,病毒可促进树突状细胞成熟和抗原呈递,如表达GM-CSF的T-VEC能增强树突状细胞的抗原呈递能力;对于自然杀伤(NK)细胞,病毒通过激活TLR2等模式识别受体及诱导Ⅰ型干扰素、IL-12等细胞因子,增强其细胞毒性;针对肿瘤相关巨噬细胞,病毒可通过阻断CD47-SIRPα抑制信号增强其吞噬活性,并促进M2型肿瘤相关巨噬细胞向抗肿瘤的M1型极化。此外,病毒还能减少髓系抑制性细胞(MDSCs)的浸润,例如通过抑制前列腺素E2(PGE2)信号或NOTCH通路,缓解其对T细胞的抑制作用。
在肿瘤基质和血管调节方面,溶瘤病毒可通过表达透明质酸酶、松弛素等分子降解细胞外基质,减少肿瘤纤维化,促进病毒扩散和免疫细胞浸润。例如,表达透明质酸酶的溶瘤腺病毒ICOVIR17能降解胶质母细胞瘤细胞外基质中的透明质酸,改善肿瘤微环境免疫表型;病毒还可破坏肿瘤血管生成,如水疱性口炎病毒能激活中性粒细胞导致肿瘤血管损伤,减少肿瘤营养供应。
作为基因递送平台,溶瘤病毒可携带多种治疗基因增强疗效。例如,携带IL-12、IL-2等细胞因子可激活免疫细胞,表达抗PD-1、抗TIGIT等免疫检查点抑制剂可解除T细胞耗竭,而双特异性T细胞衔接器(BiTE)则能直接重定向T细胞杀伤肿瘤细胞(图3)。临床研究显示,T-VEC联合CTLA-4抑制剂伊匹木单抗治疗转移性黑色素瘤时,客观缓解率(ORR)达35.7%,显著高于单药治疗的16.0%,且安全性与单药治疗一致,未增加不良事件。
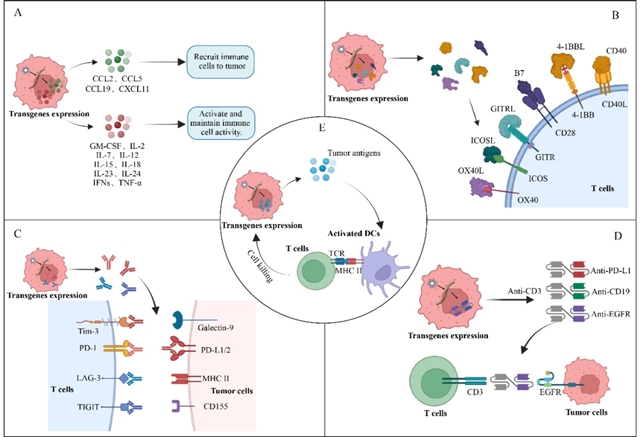
图3 溶瘤病毒可通过增强针对癌症的免疫反应提高抗肿瘤疗效
本综述系统总结了溶瘤病毒免疫疗法的作用机制与临床进展,强调其通过重塑肿瘤微环境免疫景观克服免疫抵抗的核心价值。溶瘤病毒不仅能直接裂解肿瘤细胞,更能通过诱导免疫原性细胞死亡、激活先天和适应性免疫、调节抑制性免疫细胞及基质微环境,为联合免疫检查点阻断、化疗、放疗等疗法提供了基础。尽管目前仍面临病毒复制效率、肿瘤微环境抑制、给药方式等挑战,但通过基因工程优化病毒靶向性、增强免疫调节能力,以及探索联合治疗策略,溶瘤病毒有望成为癌症综合治疗的重要组成部分。未来,随着对病毒-宿主相互作用机制的深入解析,溶瘤病毒免疫疗法或将在更多实体瘤和血液肿瘤中展现临床应用潜力。
原文信息
标题
Immune landscape and response to oncolytic virus-based immunotherapy
作者
Chaolong Lin1,2, Wenzhong Teng1,2, Yang Tian1,2, Shaopeng Li1,2, Ningshao Xia1,2, Chenghao Huang1,2
机构
1. State Key Laboratory of Vaccines for Infectious Diseases, Xiang An Biomedicine Laboratory, Department of Laboratory Medicine, School of Public Health, Xiamen University, Xiamen 361102, China
2. National Institute of Diagnostics and Vaccine Development in Infectious Diseases, State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, Xiamen University, Xiamen 361102, China
通讯作者
Ningshao Xia, Chenghao Huang
引用这篇文章
Chaolong Lin, Wenzhong Teng, Yang Tian, Shaopeng Li, Ningshao Xia, Chenghao Huang Immune landscape and response to oncolytic virus-based immunotherapy. Frontiers of Medicine, 2024, 18(3): 411-429 https://doi.org/10.1007/s11684-023-1048-0
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1048-0
https://link.springer.com/article/10.1007/s11684-023-1048-0

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。