|
|
|
|
|
靶向自噬治疗对乙酰氨基酚诱导的肝损伤:最新进展| MDPI Livers |
|
|
论文标题:Targeting Autophagy for Acetaminophen-Induced Liver Injury: An Update
论文链接:https://www.mdpi.com/2673-4389/4/3/27?n1=43&_utm_from=315ffb84f5
期刊名:Livers
期刊主页:https://www.mdpi.com/journal/livers?n1=43&_utm_from=315ffb84f5
引言:
对乙酰氨基酚(APAP)过量是西方国家急性肝衰竭的主要原因,现有N-乙酰半胱氨酸(NAC)疗法存在治疗时间窗限制,亟需开发对乙酰氨基酚诱导性肝损伤(AILI)的新疗法。AILI的肝脏发病机制涉及:1) 5–9%的APAP通过细胞色素P450酶主要是细胞色素P450 2E1(CYP2E1)和CYP1A2)代谢,形成高活性代谢物N-乙酰-对苯醌亚胺(NAPQI),过量的NAPQI会与细胞内蛋白质共价结合,形成胞浆和线粒体APAP蛋白加合物(APAP加合物),导致线粒体损伤和氧化应激增加,进而激活c-Jun N末端激酶(JNK)并释放线粒体内切酶G和凋亡诱导因子,引发DNA断裂和肝细胞坏死;2)JNK通路激活导致DNA断裂和肝细胞坏死。修复期呈现双重调节:血液中的巨噬细胞可通过清除死亡细胞和诱导中性粒细胞死亡来帮助解决损伤,在AILI恢复后期,肝脏血小板聚集增加会抑制肝脏再生。研究发现自噬通过SQSTM1/p62(p62)等受体蛋白清除毒性加合物,而转录因子EB(TFEB)可同时调控溶酶体和线粒体生物合成。因此,靶向p62/TFEB通路可能成为治疗APAP肝损伤的新策略。
靶向 p62 治疗AILI:
研究证据表明,p62蛋白通过多重机制参与AILI的调控。作为多功能支架蛋白,p62通过其PB1、ZZ、LIR、KIR和UBA等结构域分别参与自噬体形成、N-端规则降解途径、选择性自噬、NRF2通路激活和泛素化蛋白识别等过程。在AILI早期,p62通过促进APAP蛋白加合物和受损线粒体的自噬清除发挥保护作用,实验显示p62敲除小鼠肝内加合物积累加重,而p62激动剂YTK-2205可增强线粒体自噬减轻损伤。此外,p62还能通过KEAP1-NRF2通路促进抗氧化酶表达。但在AILI恢复期,p62可能通过增加肝内血管性血友病因子(VWF)分泌促进血小板聚集而抑制肝再生。这些发现提示p62在AILI不同阶段具有双重作用,其靶向治疗策略需根据病程阶段进行调整,尤其需要关注其在肝再生期调控凝血机制的作用。
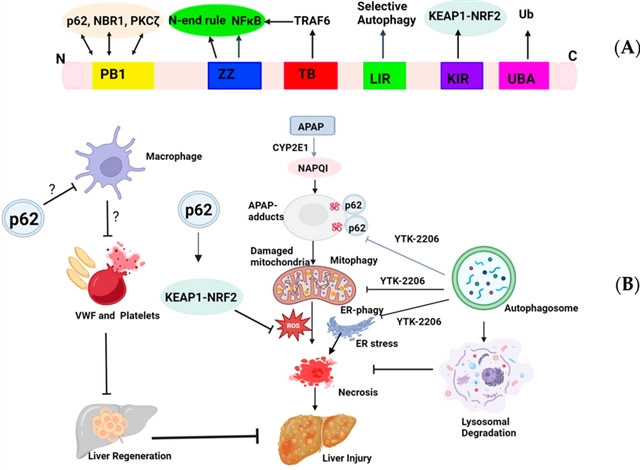
图1 针对对乙酰氨基酚诱导性肝损伤(AILI)中p62靶向作用的假设模型
靶向 TFEB 治疗 AILI
TFEB作为调控溶酶体生物合成的关键转录因子,通过多种机制参与AILI的病理过程。研究表明,TFEB的活性受mTORC1、ERK2等多条激酶通路的磷酸化调控,其激活可促进溶酶体生成和自噬通量。在AILI模型中,TFEB过表达通过以下途径发挥保护作用:(1)增强溶酶体功能以清除APAP蛋白加合物;(2)上调p62表达,通过非经典NRF2通路促进GSH再生;(3)激活PGC-1α介导的线粒体生物合成。实验证实,特异性激活TFEB的化合物(如沙利霉素和柚皮芸香苷)能减轻肝损伤,其中柚皮芸香苷通过钙调神经磷酸酶途径激活TFEB,且保护效果具有TFEB依赖性。值得注意的是,mTORC1抑制剂虽可激活TFEB,但可能干扰肝再生所需的合成代谢,因此开发不依赖mTORC1的TFEB激活剂更具治疗价值。这些发现为靶向TFEB治疗AILI提供了理论依据。
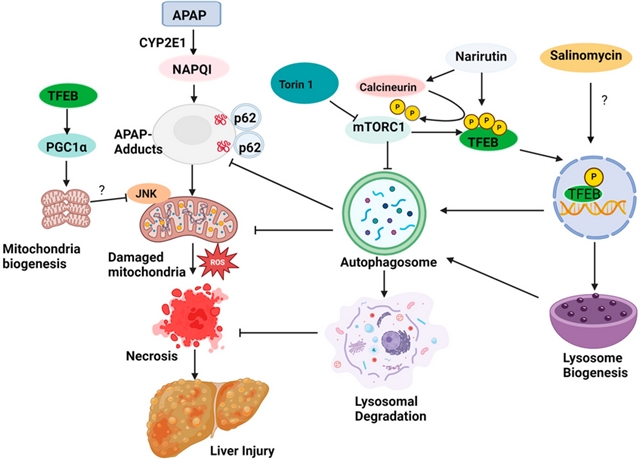
图2.自噬诱导通过清除APAP蛋白加合物和受损线粒体来预防对乙酰氨基酚诱导的肝损伤
文章总结:
证据表明自噬在清除肝脏APAP加合物和受损线粒体方面发挥着至关重要的作用,靶向p62介导的选择性自噬和TFEB介导的溶酶体生物合成是AILI的潜在治疗策略。虽然p62和TFEB的过表达可能具有致癌性,但这对于AILI患者的急性肝衰竭影响有限。未来研究应聚焦于开发特异性增强自噬的小分子药物,鉴定更多自噬激动剂,并重点评估其在肝脏修复/再生的晚期阶段的治疗效果。

识别二维码,免费阅读英文原文。
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。