|
|
|
|
|
吉林农业大学生物防治研究所:构建赤眼蜂阶段与物种特异性RNAi系统以供分子洞察 | MDPI Insects |
|
|
论文标题:Development of a Stage- and Species-Specific RNAi System for Molecular Insights in Trichogramma Wasps
论文链接:https://doi.org/10.3390/insects16070673
期刊名:Insects
期刊主页:https://www.mdpi.com/journal/insects
1. 研究背景
赤眼蜂 (Trichogramma) 作为环境友好的生物防治“天敌卫士”,被广泛应用于防控鳞翅目害虫。近年来,科研人员试图通过分子手段研究其基因功能,以提升其对农林业害虫的防治效能。然而,其微小体型 (不足1 mm) 和依赖寄主卵的复杂寄生行为,严重阻碍了相关研究的进展。因此,开发适用于这类微小寄生蜂的高效基因操作工具,特别是能够跨物种应用的RNA干扰 (RNAi) 技术,是解析其寄生机制、优化生物防治效能的迫切需求和当前研究热点。
2. 研究过程与结果
♦研究对象与方法
本研究以赤眼蜂属中两种重要的生物防治蜂种——松毛虫赤眼蜂 (T. dendrolimi) 和玉米螟赤眼蜂 (T. ostriniae) 为研究对象,聚焦于两个表型清晰且具有阶段特异性的基因:调控眼色素沉积的white基因和参与表皮硬化的laccase 2基因。研究团队系统地比较了浸泡 (Soaking) 和显微注射 (Microinjection) 两种dsRNA递送方法在不同发育阶段 (预蛹期/蛹期) 和不同蜂种间的效率差异,旨在建立一套标准化的、可跨寄主和跨物种应用的RNAi操作体系。
研究结论
结论 1:精准锁定干预“时间点”,确定靶基因表达高峰是关键
通过RT-qPCR分析white和laccase 2基因在两种赤眼蜂不同发育阶段的表达谱 (图1),发现white基因表达高峰出现在蛹早期 (T. dendrolimi) 或预蛹期 (T. ostriniae) ,而laccase 2基因则在蛹中晚期 (T. dendrolimi) 或蛹中期 (T. ostriniae) 表达量最高。这表明,要在white基因色素沉积前进行干预,需选择预蛹期;而要破坏laccase 2介导的表皮硬化过程,则需在蛹早期进行dsRNA处理。解剖表型观察 (眼色素沉积、表皮颜色变深变硬) 与基因表达图谱高度吻合,验证了选择这些时间点进行RNAi能获得最大干扰效率。
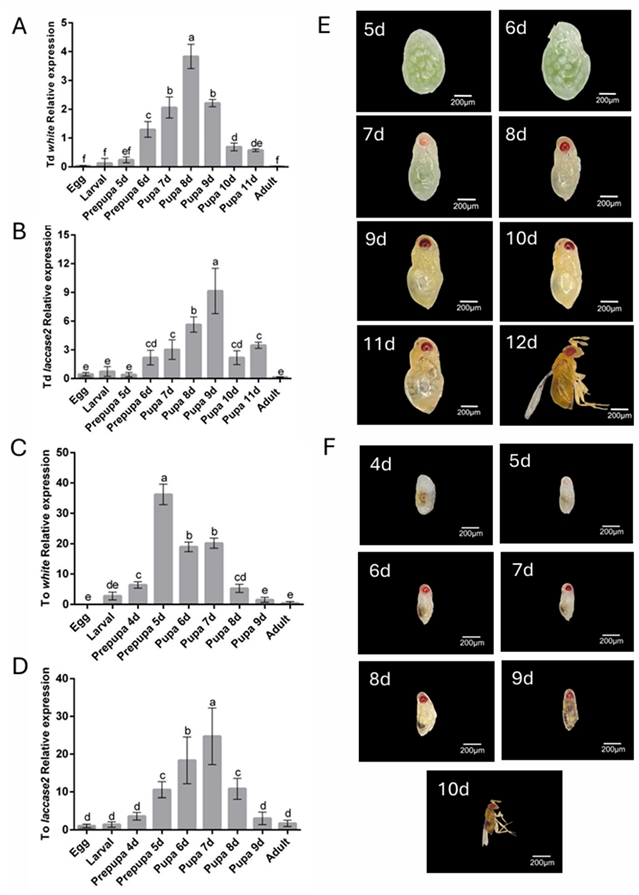
图1. white基因和laccase 2基因在松毛虫赤眼蜂T. dendrolimi (Td) 和玉米螟赤眼蜂T. ostriniae (To) 中的空间表达模式图谱和发育时间图谱。
结论 2:递送方法需“量体裁衣”,物种与阶段耐受性是关键瓶颈
生存率分析揭示了物种和发育阶段对递送方法的耐受性存在显著差异 (图2)。对于体型相对稍大的T. dendrolimi,浸泡法在其预蛹期和蛹期均表现出良好的生存率 (>50%至>80%) ,而显微注射在预蛹期则导致较高死亡率 (>60%)。相反,体型更微小 (<0.5 mm) 的T. ostriniae预蛹期对浸泡法耐受极差 (生存率仅5~15%) ,但对显微注射具有一定耐受性 (生存率30~40%) ;在其蛹期,显微注射的生存率 (60~80%) 也显著高于浸泡法 (30~50%)。因此,T. dendrolimi优先选择浸泡法,而T. ostriniae预蛹期须使用显微注射,蛹期两者均可,但显微注射生存率更高。
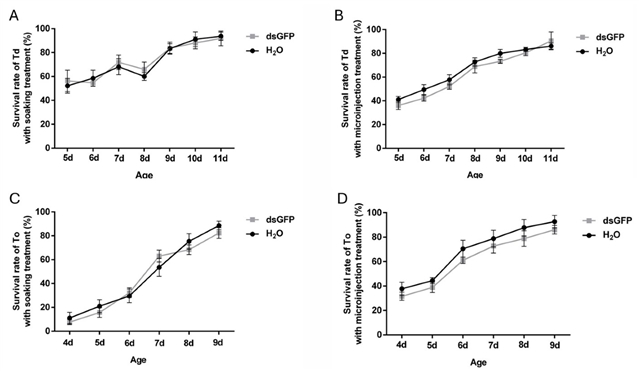
图2.浸泡和显微注射处理对松毛虫赤眼蜂T. dendrolimi (Td) 和玉米螟赤眼蜂T. ostriniae (To) 存活率的影响。
结论 3:浓度与时间“双管齐下”,优化参数实现高效沉默
时间优化:针对浸泡法,测试了不同处理时长 (12 h, 24 h, 48 h) 的效果 (图3)。结果显示,48 h浸泡通常能获得最高的基因沉默效率 (如T. dendrolimi中white沉默效率达83.23%,laccase 2沉默效率达84.29%)。T. ostriniae预蛹期浸泡white基因dsRNA因高死亡率无法获得可靠数据,但其蛹期浸泡laccase 2基因dsRNA 48小时也达到74.63%沉默效率。
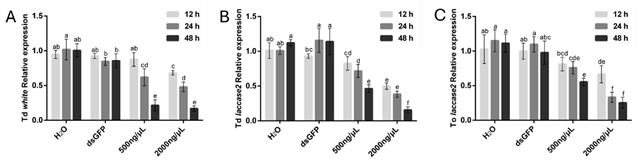
图3.在不同的dsRNA浸泡时间下,RNAi介导的松毛虫赤眼蜂T. dendrolimi (Td) 和玉米螟赤眼蜂T. ostriniae (To) 中white和laccase 2基因的沉默效率。
浓度优化:测试了不同浓度dsRNA (100~2000 ng/μL) 的效果 (图4、5)。
white基因:T. dendrolimi浸泡法在2000 ng/μL达到85.61%转录抑制,显微注射在2000 ng/μL达84.29%。T. ostriniae (显微注射) 在2000 ng/μL达到89.36%抑制。表型上,高浓度处理导致显著比例的白眼蛹 (T. dendrolimi浸泡45.07%,显微注射64.06%;T. ostriniae显微注射32.09%)。
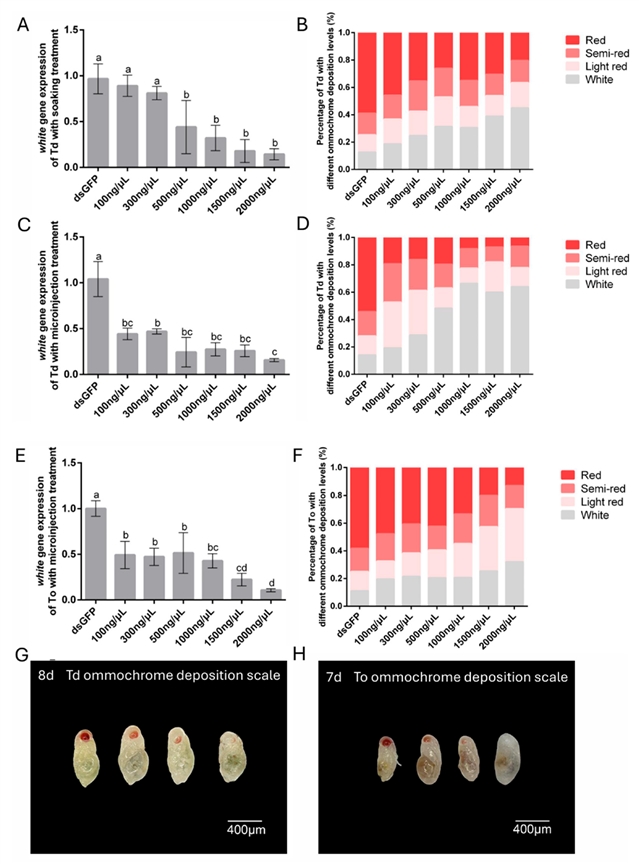
图4. 通过浸泡法和显微注射法在松毛虫赤眼蜂T. dendrolimi (Td) 和玉米螟赤眼蜂T. ostriniae (To) 中进行RNAi后white基因表达情况和色素沉积程度及表型变化。
laccase 2基因:T. dendrolimi浸泡法在2000 ng/μL达到88.35%抑制,显微注射在2000 ng/μL为60.99%。T. ostriniae浸泡法在2000 ng/μL达73.31%抑制,显微注射在2000 ng/μL达89.36%。表型上,基因沉默导致表皮硬化不完全,虫体软化畸形 (图5E、F)。值得注意的是:在1000~2000 ng/μL浓度下,浸泡法可以达到与显微注射相当的沉默效率 (尤其在耐受性好的阶段和物种)。低浓度 (如100 ng/μL) 显微注射也能在T. ostriniae中达到约50%的white和laccase 2沉默效率,表明微小膜翅目寄生蜂对dsRNA具有较高的生物可利用度,但存在潜在的RNAi机制饱和阈值。
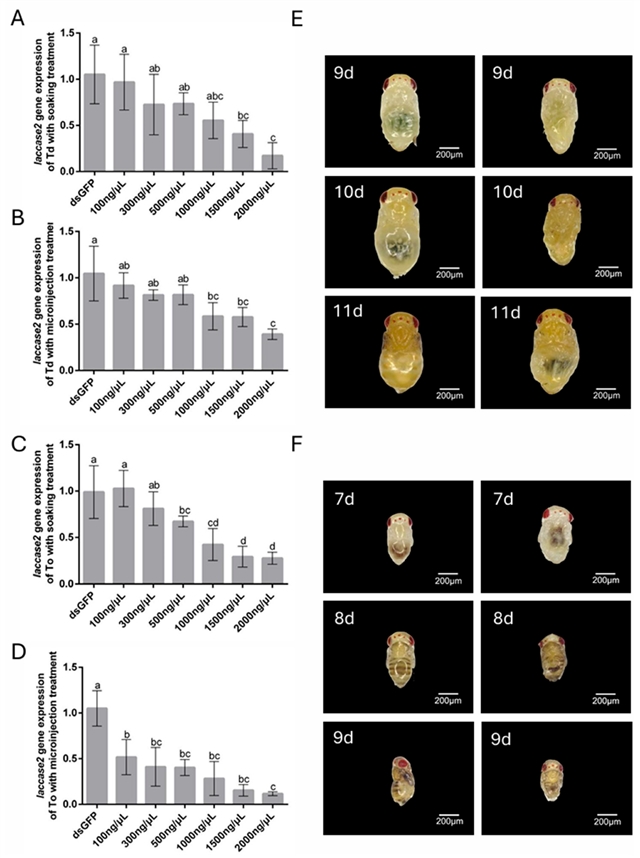
图5. 通过浸泡法和显微注射法在松毛虫赤眼蜂T. dendrolimi (Td) 和玉米螟赤眼蜂T. ostriniae (To) 中进行RNAi后laccase 2基因表达情况和表型变化。
结论 4:表型验证“一目了然”,基因沉默效果显著
white基因沉默:导致眼色素显著减少,根据色素沉积程度将表型分为四级 (Class I 全红-Class IV 全白) (图4G、H)。高浓度dsRNA处理显著提高了白眼蛹 (Class IV) 的比例 (图4B、D、F)。laccase 2基因沉默:导致表皮鞣化和硬化过程受阻,48 h后处理组个体表现出表皮软化、畸形,无法正常羽化 (图5E、F)。
3. 研究总结
本研究成功克服了赤眼蜂微小体型和物种差异带来的技术瓶颈,首次建立了一套适用于多种赤眼蜂 (松毛虫赤眼蜂和玉米螟赤眼蜂) 的阶段与物种特异性的高效RNAi技术体系。其核心突破在于:精准定位干预时机:依据靶基因的表达高峰确定最佳RNAi处理阶段。优化递送策略:耐受性好的T. dendrolimi:预蛹期和蛹期优先采用浸泡法。体型更微小的T. ostriniae:预蛹期须使用显微注射来避免高致死率,蛹期显微注射或高浓度 (1000~2000 ng/μL) 浸泡法均可达到高效沉默 (>73%)。明确参数:48 h浸泡和2000 ng/μL的dsRNA浓度是实现高效沉默的可靠组合,尤其在浸泡法可行的条件下。显著表型验证:成功实现了对眼色素沉积white基因和表皮硬化laccase 2基因这两个关键生物学过程的有效干扰,并获得清晰可辨的表型。
综上所述,这项研究不仅解决了长期困扰赤眼蜂功能基因组研究的技术难题,为在分子尺度深入解析赤眼蜂-寄主相互作用的机制提供了强大的工具,也为未来通过基因工程手段精准改良赤眼蜂、发展新一代高效生物防治技术奠定了坚实的方法学基础。
原文信息
吉林农业大学农业现代化综合技术研究所胡莹教授与王晓博士后为本研究的共同通讯作者,2023级硕士研究生杨泽龙为第一作者。吉林农业大学农业现代化综合技术研究所张俊杰教授、杜文梅副教授、张雪副教授以及吉林农业大学植物保护学院彭钊教授为本研究提供了重要技术支撑与理论指导。该研究得到了国家重点研发计划政府间国际科技创新合作专项和国家自然科学基金项目的资助。
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。