导读
癌症作为全球最主要的健康威胁之一,其研究与治疗面临着诸多严峻挑战。传统的癌症诊断和治疗评估方法,如活体组织活检,往往具有侵入性且难以实现实时、动态的监测。尤其是在分子层面,肿瘤微环境的复杂性、癌细胞特有的代谢重编程以及高度的肿瘤异质性,要求我们必须开发出能够深入到亚细胞级别,并提供定量信息的无损成像技术。
传统荧光显微镜主要依赖荧光强度进行成像,但这种方法存在诸多固有缺陷。荧光强度极易受到荧光探针浓度、激发光强度、探测器灵敏度以及组织散射和吸收等外部因素的影响。这导致数据难以进行精确的定量分析,可重复性差,尤其在对深层组织进行成像时,背景噪音和“内滤效应”会严重干扰结果的准确性。此外,传统方法也难以区分光谱重叠的荧光分子,更无法解析单个荧光分子在游离态或蛋白结合态等不同环境下的微妙变化。
针对这些技术瓶颈,目前一种变革性的解决方案是荧光寿命成像显微技术(fluorescence lifetime imaging Microscopy,FLIM)。近日,印度马尼帕尔高等教育学院的Nirmal Mazumder领导研究团队与合作者,在Light: Advanced Manufacturing发表一篇题为Application of fluorescence lifetime imaging-integrated deep learning analysis for cancer research的综述文章,探讨了FLIM在癌症研究中的变革性作用。FLIM通过测量自发荧光团的荧光寿命来量化代谢活动,从而能够精准洞察肿瘤生物学。深度学习的集成增强了FLIM的诊断潜力,使其能够自动进行图像分析,识别细微的代谢变化,并提高分类准确性。应用范围涵盖实时药物监测、肿瘤边缘识别以及早期诊断。该综述概述了FLIM仪器、计算模型和临床相关性方面的进展,并强调了其在精准肿瘤学和无创癌症监测方面的潜力。
何为FLIM?
FLIM是一种先进的荧光成像技术,其核心原理在于测量荧光分子从受激态回到基态的平均时间,即“荧光寿命”。这个时间通常在纳秒级别(10-9至10-6s)。与依赖荧光强度进行成像的传统方法不同,FLIM具有以下显著优势:
自参考特性: 荧光寿命是荧光分子的一种内在属性,不受荧光探针浓度、激发光强度或探测器灵敏度等外部因素影响。这种“自参考”的特性确保了FLIM数据的高度定量性和可重复性,无需进行繁琐的校准过程。
环境敏感性: 荧光寿命对分子所处的微环境,如pH值、离子浓度、分子结合状态、黏度等,极为敏感。这使得FLIM能够成为探究细胞内动态生物过程的“活体传感器”,例如,通过FLIM可以区分关键代谢辅酶NADH的游离态和蛋白结合态。
无标记能力: FLIM可以利用还原型烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NADH)和黄素腺嘌呤二核苷酸(Flavin Adenine Dinucleotide,FAD)等细胞内源性代谢辅酶的自发荧光,实现对细胞代谢状态的无标记、无损成像。这对于深入研究干细胞、癌细胞和免疫细胞的代谢机制至关重要。
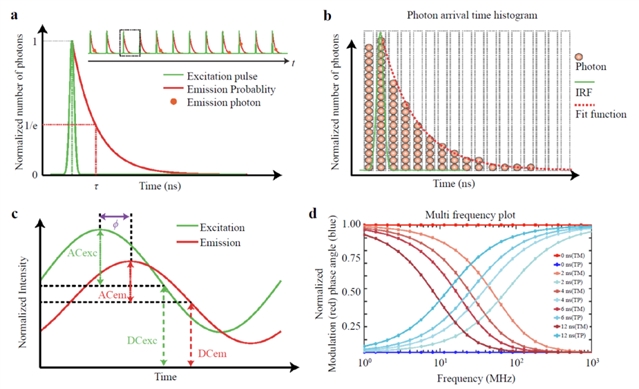
图1:时域和频域FLIM原理图
FLIM主要分为两种技术路径:时域FLIM和频域FLIM。它们各有优劣,适用于不同的应用场景。
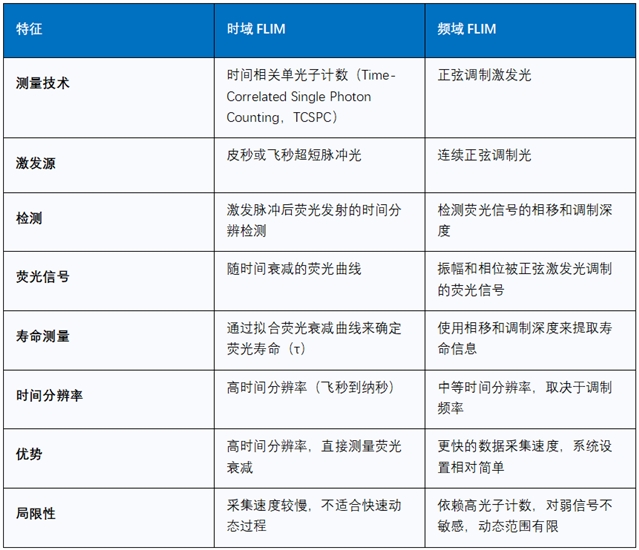
深度学习如何赋能FLIM?
FLIM技术虽然强大,但其生成的数据是多维的(空间位置、时间衰减曲线、荧光寿命等),数据量巨大且复杂。传统的手动分析方法不仅耗时,而且容易受到主观因素影响。深度学习(Deep Learning,DL)的引入,正是为了解决这一关键挑战。
DL在FLIM中的作用,是通过强大的算法模型,为数据的处理和解读提供了前所未有的计算能力。具体而言:
自动化分析与特征提取: 深度学习模型,特别是擅长处理多维数据的卷积神经网络,可以自动从复杂的FLIM数据集中识别并提取与癌症生长、转移和治疗反应相关的细微特征和模式,无需人工干预。
提升诊断与预测能力: 结合DL的FLIM技术能够以极高的准确性和可扩展性对组织进行分类,识别生物标志物,甚至在术中实时评估肿瘤边界,或在临床前模型中评估药物疗效。
工作流自动化: DL能够自动化复杂的荧光显微镜工作流,显著减少人为干预,降低了技术门槛,使得这一先进技术更加普及。
FLIM的定量数据为DL模型提供了高质量的训练基础,DL则能够从这些细微的生物学变化中学习,从而实现了高精度、高可信度的自动化诊断。这种协同作用使得DL能够发挥其最大潜力,将FLIM从一个强大的研究工具提升为一个可扩展、可自动化的临床诊断平台,从而在两者都无法独立完成的任务上实现了质的飞跃。
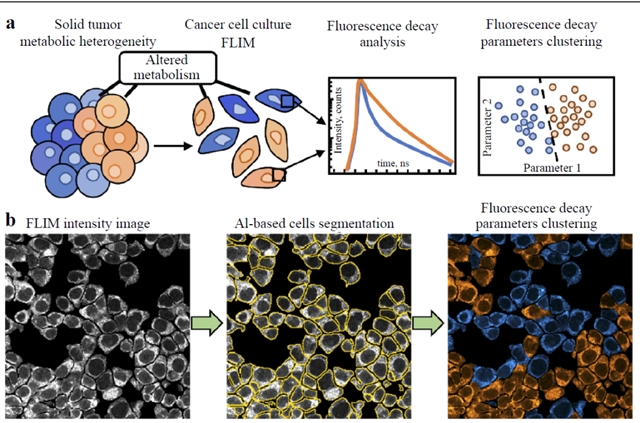
图2:FLIM 评估肿瘤代谢异质性的示意图。a FLIM 分析肿瘤代谢异质性的示意图,重点展示了从代谢改变检测到荧光衰减参数聚类的过程。b FLIM 数据处理流程:(左)FLIM 强度图像,(中)基于 AI 的细胞分割,(右)荧光衰减参数聚类
核心技术与应用解析
1 精准绘制肿瘤代谢图谱
FLIM在揭示肿瘤代谢重编程方面的能力是其最引人注目的应用之一 。癌细胞通常表现出“瓦尔堡效应”,即在有氧条件下也偏好糖酵解 。FLIM通过测量NADH和FAD这两种关键代谢辅酶的荧光寿命,可以直接反映细胞的代谢状态。游离态NADH寿命短(约0.3-0.5 ns),主要与糖酵解相关;而蛋白结合态NADH寿命长(约3-5 ns),主要与线粒体氧化磷酸化相关。
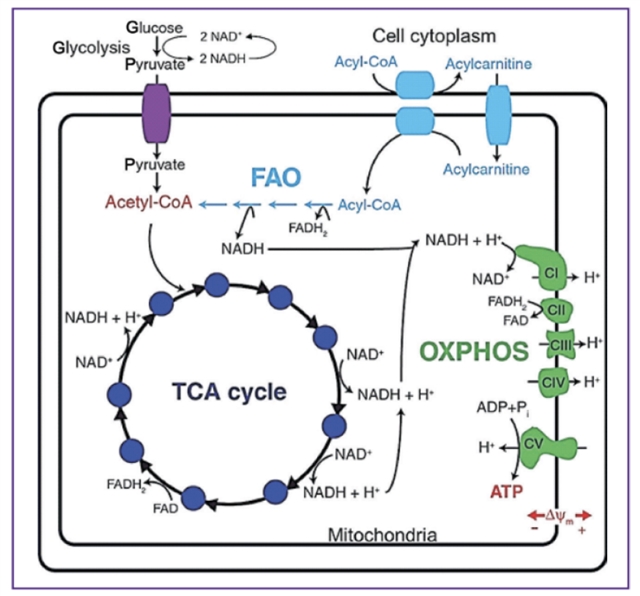
图3:NADH和FAD参与细胞能量代谢的示意图,阐明它们在糖酵解、脂肪酸氧化(FAO)、三羧酸(TCA)循环和氧化磷酸化中的关键作用
应用案例: 研究表明,基底细胞癌(Basal Cell Carcinoma,BCC)和鳞状细胞癌(Squamous Cell Carcinoma,SCC)组织的NADH荧光寿命比周围健康组织短,反映了其代谢模式向糖酵解的转变。通过FLIM,研究人员可以量化“荧光寿命诱导氧化还原比”,即酶结合态NADH与FAD的比值,以此动态追踪代谢的转变。在乳腺癌小鼠模型中,FLIM比传统的氟代脱氧葡萄糖正电子发射断层扫描(Fluorodeoxyglucose Positron Emission Tomography,FDG-PET)成像更早(48小时内)发现了治疗引起的代谢变化。此外,FLIM还能揭示肿瘤内部的代谢异质性,例如在3D乳腺癌球体模型中,FLIM发现了代谢梯度,外围细胞表现出更高的荧光寿命诱导氧化还原比值,预示着更强的迁移表型。
深度学习在这一过程中发挥了关键作用。AI辅助的细胞分割技术可以精确识别单个细胞,并对荧光寿命参数进行聚类分析,从而深入理解肿瘤微环境内的异质性。下表概述了FLIM与DL在不同癌症类型中的具体应用。
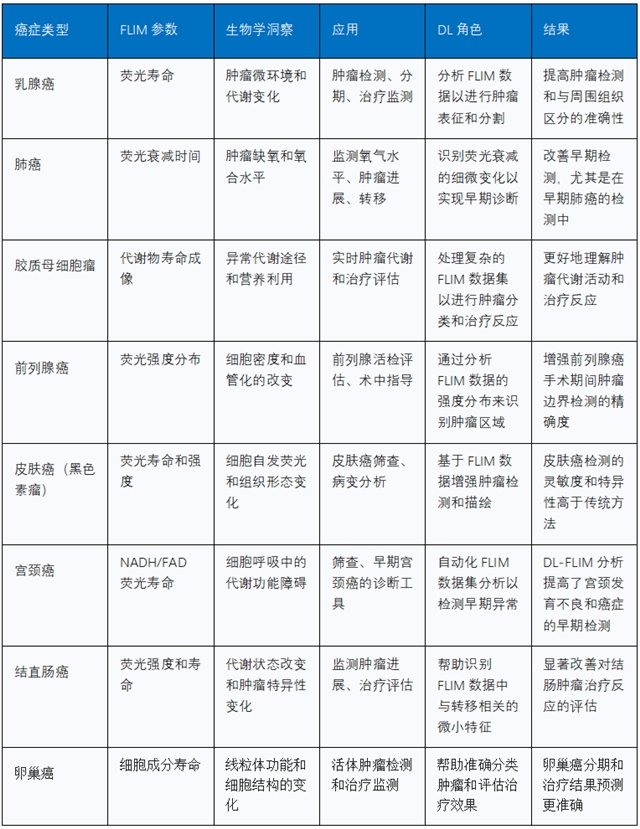
2 实时监测药物递送与疗效评估
FLIM-荧光共振能量转移(Förster Resonance Energy Transfer,FRET)技术利用荧光寿命的变化来监测分子间的距离和相互作用,为实时追踪药物分子在细胞内的运动轨迹、释放机制和作用靶点提供了强大工具。
应用案例: FLIM-FRET被用于研究化疗药物如紫杉醇(Paclitaxel,PTX)和多柔比星(Doxorubicin,DOX)的细胞摄取和释放机制,揭示了外泌体(Exosomes,EXOs)和微囊泡(Microvesicles,MVs)不同的药物递送途径。一项研究利用FLIM区分了金-DOX纳米复合物(Au-Dox)在癌细胞和健康心肌细胞中的不同内化路径,解释了其选择性毒性的机制,为减少化疗副作用提供了依据。此外,FLIM还能通过检测细胞核荧光寿命的早期变化,评估达沙替尼(Dasatinib)等抗癌药物的疗效,甚至可以在单细胞分辨率下生成药效剂量-反应曲线。
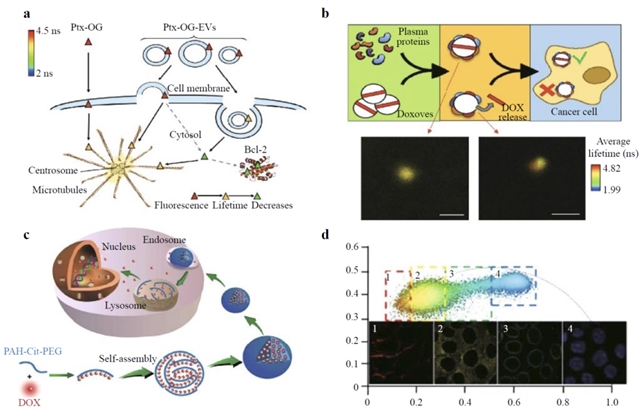
图4:FLIM在药物递送的应用
3 光动力疗法的精准优化
光动力疗法(PDT)通过光敏剂、特定波长光和氧气生成活性氧(ROS)来杀伤癌细胞。FLIM在PDT中的应用尤为突出,它可以精确定位光敏剂(如原卟啉IX(Protoporphyrin IX,PPIX))在细胞内的亚细胞位置,甚至在光谱重叠的情况下区分不同卟啉化合物,这对于理解和优化治疗效果至关重要。
应用案例: FLIM能够追踪PPIX在线粒体中的富集,而线粒体是产生高光毒性的关键部位,这为PDT的精确打击提供了依据。另一项研究利用FLIM结合NADH-FLIM,开发了溴代靛红类化合物作为氧气传感器,通过检测细胞代谢从氧化磷酸化向糖酵解的转变,来预测PDT在低氧环境下的治疗效果。一种新型的铱(III)络合物(Ir-OH)被发现具有黏度响应的荧光寿命,FLIM可用于实时监测其诱导的细胞凋亡,从而为PDT治疗提供实时指导。
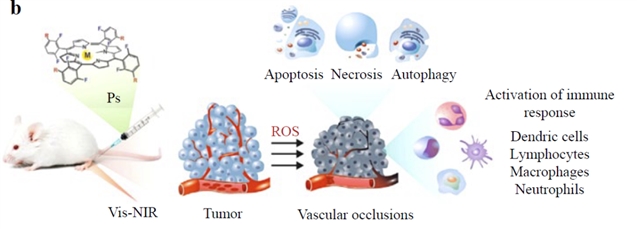
图5:光动力疗法原理图
4 DL-FLIM的未来:无标记虚拟染色与自动化诊断
深度学习的引入,使得FLIM从一个强大的研究工具迈向了自动化的临床诊断平台。一个显著的进展是利用DL将FLIM的无标记图像(例如NADH/FAD的自发荧光图像)作为输入,生成高准确度的“虚拟”组织病理学染色图像(如苏木精-伊红染色(Hematoxylin and Eosin staining,H&E))。
技术核心与应用: 基于pix2pix生成对抗网络的DL框架,可以从无标记FLIM数据中重建细胞级别的虚拟H&E染色图像,成功区分肺癌、结直肠癌和子宫内膜癌等多种癌症组织。这使得快速病理诊断成为可能,极大地减少了传统病理学对组织切片和染色的依赖。一项针对子宫内膜癌的研究利用黏度敏感荧光探针结合FLIM,并使用DL模型(ResNeSt-50)对微创细胞学样本进行分类,实现了84.6%的灵敏度和75.0%的特异性。这种方法克服了传统病理学对组织形态的单一依赖,结合了微环境信息(如黏度),大大提升了诊断的精准性。
DL在FLIM数据处理速度上的突破也使得其走向临床应用成为可能。例如,有研究表明,基于人工神经网络的寿命估计模型可以将256x256像素的图像处理时间缩短到0.9秒。FLI-Net等卷积神经网络模型甚至比传统方法快30倍,使得FLIM的实时成像和诊断成为可能。这种技术组合正在构建一个从早期筛查、术中指导到疗效评估的“无缝连接”的癌症诊疗闭环,是精准医疗的真正体现。
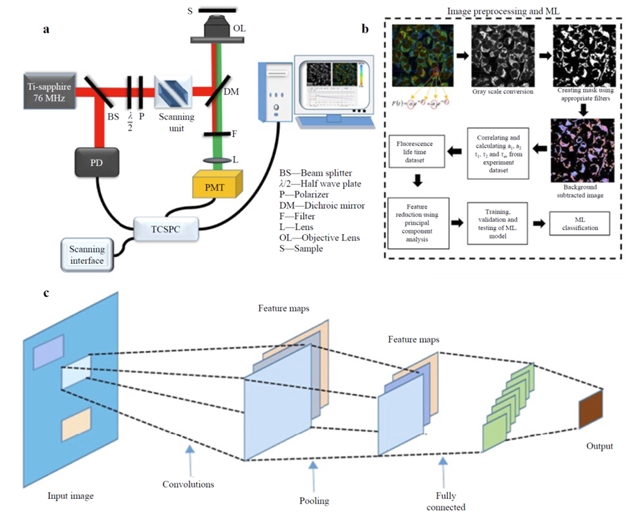
图6:FLIM与DL的集成概念图
待优化方向、挑战及未来展望
尽管FLIM与DL的集成展现了巨大的潜力,但其大规模应用仍面临多重挑战。
当前挑战
高昂的成本与复杂性: FLIM仪器设备,如超快激光器和TCSPC系统,成本高昂且操作复杂,需要专业知识,这限制了其在常规临床环境中的普及。
数据挑战: 深度学习需要海量、高质量的标注数据集,但FLIM数据的获取和标注过程耗时且困难。此外,在低光子计数下的数据精度和模型泛化能力也是一个难题。
标准化缺失: 目前缺乏统一的成像协议和数据分析标准,导致不同研究机构之间的数据可比性和可重复性受到影响。
集成与验证: 将FLIM与其他成像模态(如多光子显微镜)融合,并获得临床监管机构的验证,仍是巨大的挑战。
未来展望
设备小型化与便携化: 解决当前挑战正是实现宏大未来愿景的必经之路。未来的研究将致力于开发更便携、用户友好、成本更低的FLIM设备,使其能够进入更广泛的临床应用场景。
算法创新与数据融合: 持续开发更高效、更鲁棒的DL算法,以解决低光子计数、数据泛化能力差等问题。同时,将FLIM与其他多模态成像技术深度融合,以获取更全面的生物学信息,例如将FLIM与超分辨率显微镜结合,以提供更精细的图像深度和分辨率。
走向临床: 随着技术成熟和标准化协议的建立,FLIM-DL有望成为非侵入式、无标记组织表征和个性化癌症治疗的不可或缺的工具,最终改变医疗保健的面貌,并为癌症生物学研究提供新见解。(来源:先进制造微信公众号)
相关论文信息:https://doi.org/10.37188/lam.2025.049
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。