5月20日,中国科学院上海免疫与感染研究所陈昌斌研究组联合南昌大学基础医学院黄孝天研究组、军事医学研究院病原微生物生物安全国家重点实验室周冬生研究组,在国际期刊 Nature Communications 在线发表了题为“Targeting epigenetic regulators to overcome drug resistance in the emerging human fungal pathogen Candida auris”的研究论文。该研究通过深入探究组蛋白H3翻译后修饰调控因子与“超级真菌”耳念珠菌的耐药性及致病性之间的关系,揭示了组蛋白H3乙酰转移酶Gcn5在调控耳念珠菌耐药性和致病性中的关键作用,提出了Gcn5特异性抑制剂CPTH2与棘白菌素类药物卡泊芬净联用方案,为临床上应对耳念珠菌耐药问题提供了新的解决策略。
自2009年首次被发现以来,耳念珠菌已蔓延至全球六大洲40余个国家的医疗机构,其引发的院内感染在重症监护病房(ICU)中表现出高度的传播性和耐药性。新冠疫情大流行期间,包括美国、德国、印度和墨西哥等多个国家均报道了耳念珠菌在ICU病房爆发感染的事件。该病原体对主要抗真菌药物(如氟康唑)的耐药率超过90%,并且在药物胁迫下能够迅速获得新的耐药性,使得治疗变得极为困难,侵袭性感染的病死率最高可达70%。更严峻的是,其强大的环境耐受性可使病菌在医疗设备表面持续存活,常规消毒手段难以彻底清除,显著增加了医院交叉感染的风险。世界卫生组织(WHO)在2022年发布的首份真菌重点病原体清单中,将其列为最高风险等级。
组蛋白翻译后修饰作为表观遗传调控的核心机制,在肿瘤治疗领域已展现出巨大潜力。近年研究发现,组蛋白乙酰化、甲基化等修饰不仅调控肿瘤细胞的增殖与转移,更为开发靶向表观遗传酶的抗癌药物(如HDAC抑制剂)提供了理论基础。这种通过调控表观遗传机制干预疾病进程的策略,为抗感染研究提供了重要启示。组蛋白翻译后修饰是否可用于病原真菌感染治疗,目前尚缺乏相关研究报道。
基于此,本研究团队通过系统解析组蛋白H3翻译后修饰调控网络(重点分析了乙酰转移酶Gcn5和Rtt109,以及甲基转移酶Set1、Set2和Dot1的功能),首次发现乙酰转移酶Gcn5在耳念珠菌耐药性调控中的核心作用。为进一步揭示Gcn5调控耳念珠菌耐药性的分子机制,研究团队综合运用转录组分析、染色质免疫共沉淀(ChIP)等多种实验技术,发现Gcn5通过介导组蛋白H3乙酰化修饰,直接调控麦角固醇生物合成关键基因(如ERG11)以及药物外排相关基因(如CDR1和MDR1)的表达,从而增强耳念珠菌对唑类抗真菌药物的耐药性。进一步研究还发现,Gcn5可通过直接调控钙调神经磷酸酶信号通路及转录因子Cas5,影响细胞壁完整性及其对棘白菌素类药物的耐药性。在感染模型中,缺失Gcn5亦显著降低了耳念珠菌的致病能力。
为验证Gcn5作为抗耳念珠菌感染药物靶点的可行性,研究团队采用特异性抑制剂CPTH?,靶向阻断Gcn5介导的组蛋白H3乙酰化功能。结果显示,CPTH?与棘白菌素类药物卡泊芬净联合使用展现出显著的协同抗菌效果,且对人类细胞和小鼠均无明显毒性。
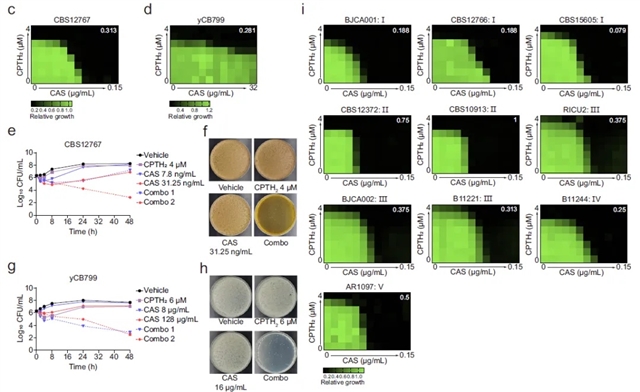
图1. Gcn5特异性抑制剂CPTH2与卡泊芬净联用展现显著协同杀菌效应
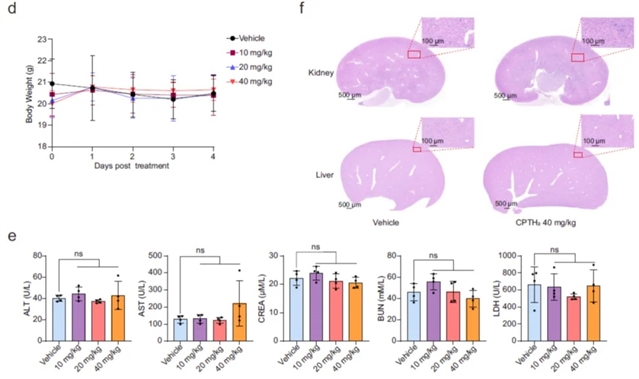
图2. CPTH2小鼠体内安全性评估显示良好生物相容性
本研究首次揭示了Gcn5在耳念珠菌耐药性与致病性中的核心作用,提出了一种通过靶向表观遗传调控因子以克服真菌耐药性的全新治疗策略。鉴于耳念珠菌在全球范围内的快速传播及对现有抗真菌治疗手段的高度抗性,未来有针对性地对CPTH2进行结构优化或开发更高效的Gcn5特异性抑制剂,有望为临床应对多重耐药耳念珠菌感染提供全新的解决方案。(来源:中国科学院上海免疫与感染研究所)
相关论文信息:https://www.nature.com/articles/s41467-025-59898-6
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。