近日,中国科学院广州生物医药与健康研究院研究员李鹏/孔祥谦团队研究揭示了DNA甲基转移酶1(DNMT1)通过表观遗传与蛋白质互作双重机制维持T细胞身份的关键作用,研发了通过表观遗传小分子抑制剂将T细胞诱导重编程为同时具有T细胞和自然杀伤细胞功能的自然杀伤样细胞,有望为癌症免疫细胞治疗提供一种新细胞源。相关成果发表于《科学免疫学》(Science Immunology)。
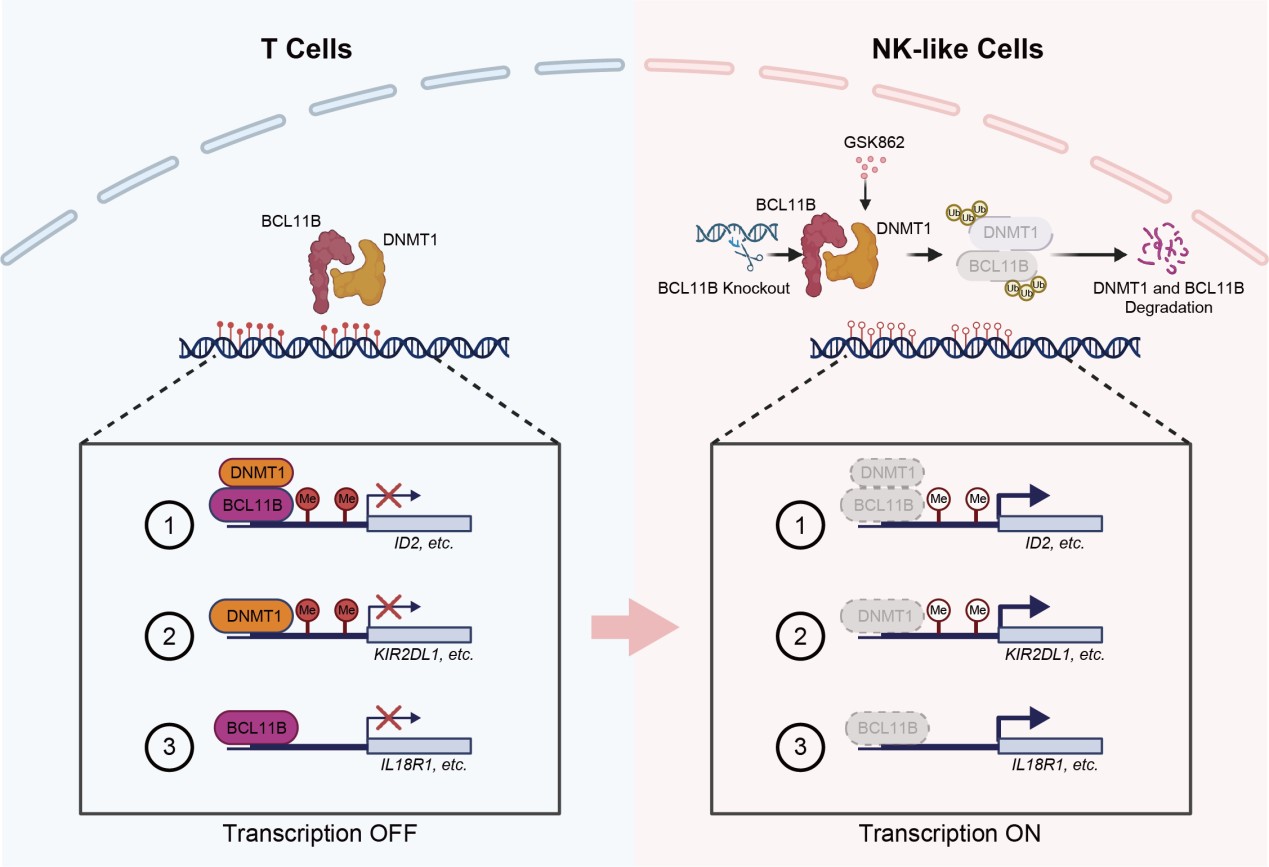 BCL11B与DNMT1协同抑制自然杀伤细胞相关基因表达,维持T细胞身份。研究团队供图
BCL11B与DNMT1协同抑制自然杀伤细胞相关基因表达,维持T细胞身份。研究团队供图
?
T细胞和自然杀伤细胞都是重要的免疫细胞。T细胞主要参与适应性免疫应答,而自然杀伤细胞是天然免疫系统的一部分,具有直接杀伤肿瘤细胞和病毒感染细胞的能力。它们在肿瘤免疫中体现出高度的互补性:T细胞可识别表达主要组织相容性复合体的癌细胞,自然杀伤细胞则通过自然杀伤细胞受体来识别主要组织相容性复合体缺失的癌细胞。
BCL11B是T细胞谱系发育和T细胞身份维持的关键转录因子。研究团队在国家重点研发计划、国家自然科学基金等项目的资助下,研究发现DNMT1/UHRF1复合物与BCL11B存在相互作用,且DNMT1通过N端结构域直接结合BCL11B的锌指结构域,阻止其被泛素化降解。进一步发现,BCL11B通过招募DNMT1/UHRF1复合物到自然杀伤细胞相关基因的启动子区域,导致该区域的DNA甲基化修饰,从而抑制相关基因的转录。
阐明BCL11B与DNMT1协同维持T细胞身份分子机理后,研究团队对人外周血来源的T细胞用DNMT1的选择性抑制剂GSK862进行处理,导致BCL11B和DNMT1的蛋白降解,从而导致NKp30和NKp46等多种自然杀伤细胞特征性基因的转录上调,使得T细胞表现出自然杀伤细胞的功能,能够通过分泌穿孔素、颗粒酶B等效应分子来杀伤肿瘤细胞。
联合使用DNMT1的选择性抑制剂和组蛋白修饰酶EZH2的抑制剂可以进一步提升自然杀伤样细胞重编程效率和抗肿瘤活性。这种由表观遗传小分子抑制剂组合诱导获得的自然杀伤样细胞在人源化小鼠模型中展现出优异的抗肿瘤活性。CAR-T细胞也可通过同样的方法被诱导重编程为识别癌抗原更广泛,抗肿瘤活性更强的CAR-NK样细胞。
该研究首次揭示了转录因子BCL11B与表观调控复合体DNMT1/UHRF1协同维持T细胞身份的核心机制,并基于此开发了一种新型T细胞重编程技术,成功将其转化为具有肿瘤杀伤功能的自然杀伤样细胞。该研究为肿瘤的临床免疫细胞治疗提供了潜在来源,同时也为解析T细胞发育过程中的表观遗传调控提供了新的视角。(来源:中国科学报 朱汉斌)
相关论文信息:https://doi.org/10.1126/sciimmunol.adm8251