|
|
|
|
|
科学家实现杂环化合物的立体选择性C(sp3)-H键烷基化反应 |
|
|
尽管交叉偶联的策略已实现芳香杂环的官能化,但对廉价易得的饱和脂肪烃进行不对称C(sp³)–H烷基化反应,从而构建C(sp³)–C(sp³)键仍然是一项严峻挑战。
2025年2月28日,武汉大学高等研究院孔望清/平媛媛团队在Nature Chemistry期刊上发表了一篇题为“Direct stereoselective C(sp³)–H alkylation of saturated heterocycles using olefins”的研究成果。
该研究团队使用易制备的烯烃和简单易得的饱和氮/氧杂环化合物,在温和条件下实现了镍催化对映选择性C(sp³)–H键烷基化反应,该反应具有广泛的底物范围和优异的官能团耐受性。此外,该团队还通过饱和环烷烃与烯基硼酸酯的对映及非对映选择性C(sp³)–H键烷基化反应,实现了含1, 2-相邻C(sp³)立体中心的烷基硼酸酯的合成。该方法可应用于天然产物及药物的后期修饰,以及多种手性砌块和天然产物的合成。
论文的通讯作者是孔望清教授和平媛媛副研究员;第一作者是周志俊博士和柯阳博士。
通过C(sp³)–H键官能化将廉价易得的脂肪烃类化合物转化为高附加值手性化合物,因其固有的原子经济性、步骤经济性及原料丰富性,近年来受到学术界和工业界的广泛关注。近年来,氢原子转移(HAT)与过渡金属催化的交叉偶联相结合,成为实现C(sp³)–H键不对称官能化的强有力工具。目前基于HAT/过渡金属催化的C(sp³)–H氰基化、芳基化、烯基化、炔基化及酰基化已成功实现。然而,对于无导向基饱和烃类化合物的对映选择性C(sp³)–H烷基化仍极具挑战性。
武汉大学孔望清团队致力于实现各类饱和氧杂环的C(sp³)–H键官能团化反应。在2023年通过光促HAT/镍协同催化的策略,该团队成功实现了氧杂环C(sp³)–H键对映选择性芳基化和烯基化反应(J. Am. Chem. Soc. 2023, 145, 5231-5241.),在该工作中,带有多个手性中心的氧杂环的C(sp3)–H键均能实现立体选择性C(sp3)–C(sp2)键的高效构建。紧接着,该团队在此基础上进行深耕,利用光促HAT的策略活化了1-脱氧糖苷上的C(sp3)–H键,随后在镍催化剂以及配体的调控下,实现区域选择性和立体选择性的官能团化反应(Nat. Chem. 2024, 16, 2054–2065)。
在完成各类饱和氧杂环的立体选择性的官能化后,作者进一步尝试更具挑战性的饱和氮/氧杂环的不对称C(sp³)–H键烷基化反应,而关于未导向氧杂环的对映选择性C(sp³)–H键烷基化目前尚未报道。该团队将镍催化过氧化物介导的C(sp³)–H键官能化及Ni–H催化体系所实现的烯烃氢烷基化研究相结合,开发了一种饱和氮/氧杂环与烯烃的立体选择性C(sp³)–H烷基化方法。

图1:饱和氮/氧杂环与烯烃的立体选择性烷基化反应研究。
该团队首先以吡咯环烷烃与非活化烯烃为底物进行反应条件优化,最终以良好的收率和优异的立体选择性得到了C(sp³)–H烷基化的目标产物。随后作者对烯烃底物的适用范围进行了考察(图2),结果表明各类官能团均能在该反应体系下兼容。值得注意的是,当使用内烯烃时,反应涉及Ni–H物种的链行走过程,促使C(sp³)–C(sp³)成键的位置在端位C(sp³)–H键而非原位。
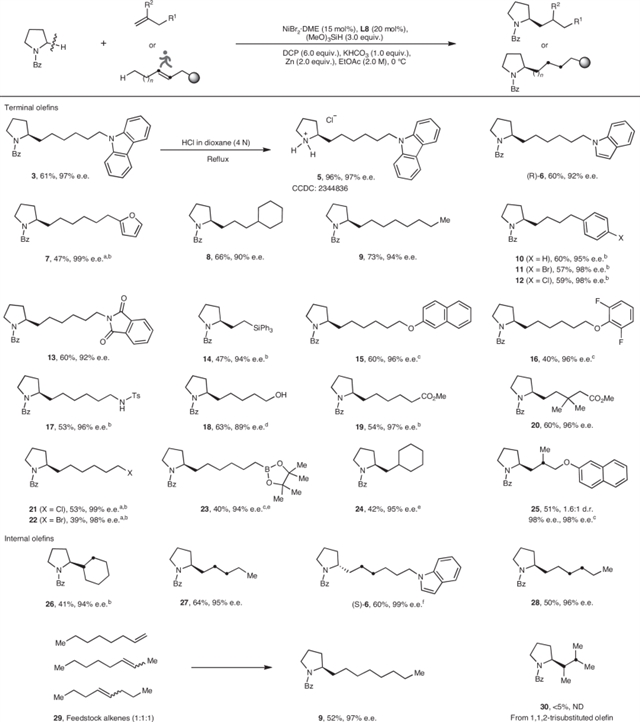
图2:烯烃的底物拓展。
随后作者考察了各类杂环烷烃的底物范围,多种饱和氮/氧杂环均能以良好产率及优异对映选择性实现烷基化(图3)。值得注意的是,以丙酮叉保护的乙二醇及1, 3-丙二醇可高效实现氧邻位C–H键烷基化,为合成高附加值手性1, 2-和1, 3-二醇提供了模块化方案。进一步作者还将该策略应用于天然产物及药物分子的后期修饰。
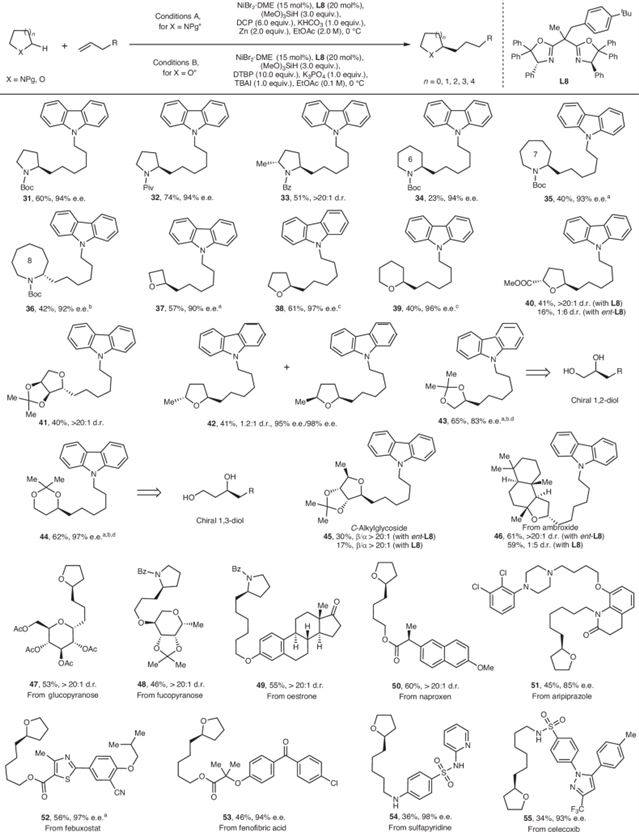
图3:饱和杂环烷烃的底物拓展。
此外,该团队还通过饱和环烷烃与烯基硼酸酯的对映及非对映选择性C(sp³)–H键烷基化,实现了含1, 2-相邻C(sp³)立体中心的烷基硼酸酯的合成(图4)。
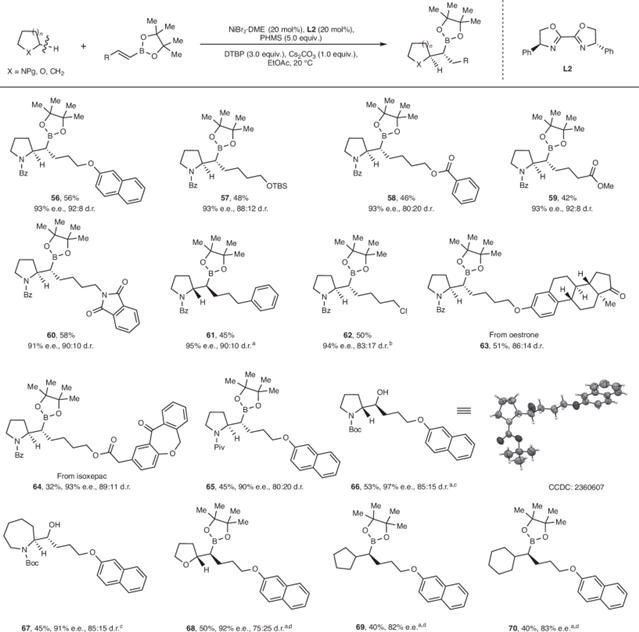
图4:含1, 2-相邻C(sp³)立体中心的烷基硼酸酯的合成。
为展示该方法实用性,作者将该方法应用于具有生物活性的天然产物的不对称合成中(图5),包括了(R)-bgugaine、(R)-irnidine、(−)-coniceine、(−)-1-hydroxypyrrolizidine、(−)-perhydro-8-indolizinol、(−)-trachelanthamidine和(−)-tashiromine的全合成以及 (S)-lipoic acid和(−)-tetrahydrolipstatin的形式合成。
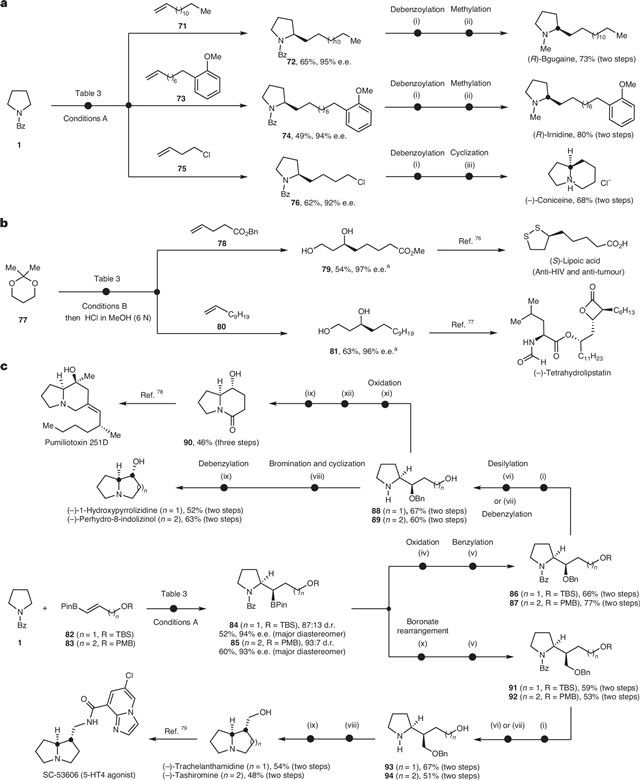
图5:合成应用。
为了阐明反应机理,作者设计了一系列实验证实了催化循环的决速步为烷氧自由基对C(sp³)–H键的攫取过程,而烷氧自由基是DCP被一价镍物种还原所形成的(图6)。
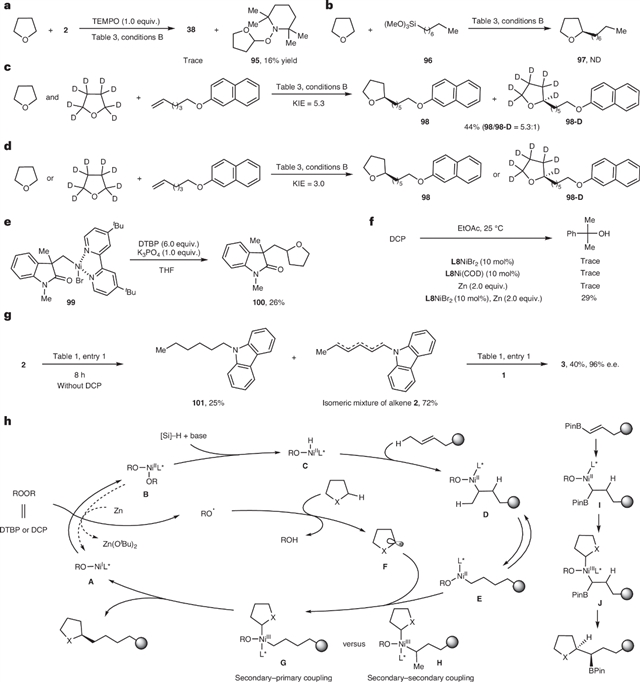
图6:机理研究。
孔望清/平媛媛团队发展了一种绿色且高效的催化体系,不仅解决了饱和环烷烃C(sp3)–H烷基化反应的手性控制难题,还利用该策略实现了含1, 2-相邻C(sp³)立体中心的烷基硼酸酯的合成。该方法已成功应用于多种手性砌块和天然产物的合成。研究成果精准高效地构建了结构多样性的手性饱和氮/氧杂环,为不对称C(sp³)–H键烷基化反应提供了可行策略和新思路。
相关论文信息:https://www.nature.com/articles/s41557-025-01747-6