2025年3月6日,武汉大学教授戚孝天团队与美国印第安纳大学化学系教授M. Kevin Brown合作在Chem期刊上发表了一篇题为“An Unconventional Photochemical Tetrahydroisoquinoline Synthesis from Sulfonylimines and Alkenes”的研究成果。
该成果报道了一种基于光化学能量转移的合成方法。通过巧妙利用磺酰亚胺的光敏特性,成功实现了其与烯烃的[4+2]环加成反应,为四氢异喹啉骨架的构建开辟了新途径。
论文通讯作者是M. Kevin Brown教授和戚孝天教授;第一作者是印第安纳大学王旺博士,理论计算部分由武汉大学赵博迪同学完成。
四氢异喹啉骨架分子作为重要的含氮杂环分子,其独特骨架结构广泛存在于天然生物碱和临床药物分子中,展现显著的镇痛、抗菌及抗癌等多种生物活性。在合成化学领域,该类化合物的构建策略研究已持续近一个世纪,传统合成路径主要依赖Pictet-Spengler环化、Bischler-Napieralski环化以及Pomeranz-Fritsch-Bobbitt环加成等经典反应体系。
然而,这些方法普遍存在显著局限性:其一,反应遵循亲电芳香取代机制,要求底物必须具有富电子芳环结构;其二,对于缺电子芳环体系难以实现有效转化,严重制约了目标产物结构的多样性。近些年发展的异喹啉氢化策略虽具有原子经济性优势,但仍未突破电子效应对反应体系的限制。
针对这一长期存在的合成挑战,作者开发了一种基于光化学能量转移的创新合成方法。通过巧妙利用磺酰亚胺的光敏特性,成功实现了其与烯烃的[4+2]环加成反应,为四氢异喹啉骨架的构建开辟了新途径。
该方法的突破性进展主要体现在以下方面:1)对强吸电子取代基的底物展现优异兼容性,有效克服传统方法对富电子体系的依赖性;2)通过收敛式合成策略,实现复杂分子结构的快速组装;3)反应表现出良好的区域选择性和非对映选择性;4)官能团兼容性强,底物适用性广。这一光驱动环加成体系的建立,不仅为缺电子四氢异喹啉衍生物的合成提供了有效解决方案,更为杂环化合物的多样性合成提供了新的设计思路。
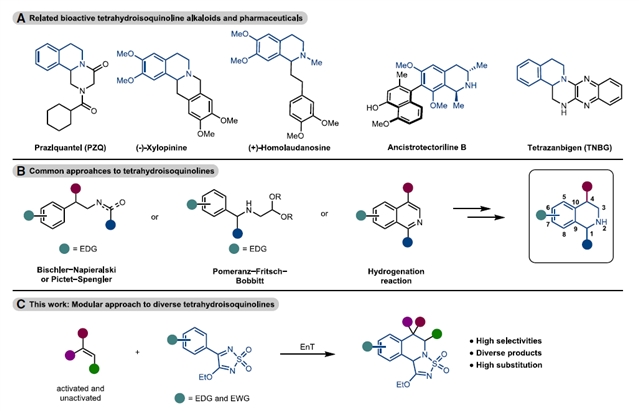
图1:研究背景。
基于以前研究工作的基础,作者合成不同的磺酰亚胺试剂进行尝试反应,作者以磺酰亚胺6为底物时可以获得高收率的环加成产物,该产物通过简单的脱保护就可以获得相应的四氢异喹啉骨架分子。通过条件优化获取最佳反应条件后,作者对该反应的底物普适性和官能团兼容进行了测试,该反应对于活化烯烃、非活化烯烃都可以很好的兼容。对于强吸电子、富电子、以及杂环化合物都可以获得相应的环加成产物。随后,对产物进行了一系列的应用转化,可以高效、简洁合成多种药物类似物。最后,作者对反应的机制进行了研究,通过控制实验、Stern-Volmer实验以及氘代实验的结果显示,该反应经历了能量转移过程。

图2:底物的选择优化。
戚孝天课题组通过密度泛函理论(DFT)计算系统研究了磺酰亚胺与苯乙烯环加成反应的选择性调控机制。计算表明,反应化学选择性取决于自由基加成后的反应路径分叉:自由基-自由基偶联过程倾向于形成[2+2]环加成产物,而苄基自由基对芳环的亲电加成则生成[4+2]产物。前线分子轨道(FMO)理论分析发现,激发态磺酰亚胺2与烯烃反应生成的三线态中间体62中,a-HOMO主要定域于三级苄基碳的p轨道,表明该位点反应活性最高。同时邻位氮原子的供电子效应增强了其强亲核性,也有助于其与亲电的二级苄基自由基发生自由基-自由基偶联,生成[2+2]环加成产物。而磺酰亚胺6对应的中间体66中,a-HOMO集中在二级苄基碳原子上,说明位点具有最高的反应活性,考虑到该位点的亲电性较强,因此更容易发生对芳环的亲电加成反应。
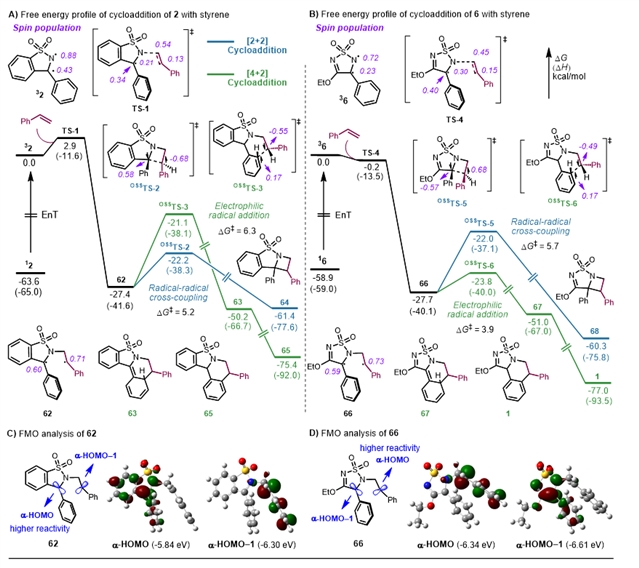
图3:DFT计算。
在这项工作中,作者提出了一种制备四氢异喹啉骨架的新策略。该策略通过独特的逆合成断键设计,突破了传统方法在构筑特殊结构分子时的壁垒,成功实现了含强吸电子基团及季碳中心等挑战性四氢异喹啉骨架分子的高效合成。此外,反应产物可以快速转化为一系列有趣的杂环磺酰胺衍生物和潜在的药物分子。最后,通过对反应机理的研究,揭示了亚胺自由基反应途径的选择性规律。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2025.102488