|
|
|
|
|
探索振动疗法在癌症治疗中的应用 Engineering |
|
|
论文标题:Exploring Shaking for Cancer Treatment
期刊:Engineering
DOI:https://doi.org/10.1016/j.eng.2024.04.001
微信链接:点击此处阅读微信文章

作者:Hiroki Yokota, 李柏岩
1 振动的双重作用
消除振动是工程领域的关键课题。例如,航天器姿态控制系统正是通过抑制振动来确保精确的三维定向。振动现象,如外部扭矩引发的进动、离轴角动量诱发的章动、几何错位导致的摆动等,均需配置主动与被动阻尼机制加以抑制。这一原理不仅适用于航天器,也适用于离心技术领域,它不仅是家用洗衣机的核心工艺,更是用于分离细胞和细胞器以及分离DNA和蛋白质的一系列生物医学设备的关键技术基础。以超速离心机为例,其转速可突破每分钟10万转并产生数千倍于地球重力(约10 m·s-2)的离心力。因此,抑制振动成为工程实践中的基本原则。而某些装置却反其道行之,主动利用振动效应实现特定功能,典型应用场景包括化学混合、粒子扩散、热能耗散等。有趣的是,越来越多的证据表明,自然系统(如人体、细胞及生物大分子等)对外界振动存在感知与响应机制[1]。这一认识促使人们有可能利用机体或细胞对于振动的响应机制攻克重大医学难题,尤其是晚期癌症。
2 细胞工程的替代疗法
在医疗应用中,以按摩疗法和全身振动疗法为代表的干预手段已被广泛接受。其中按摩可缓解多种病理状态[2]。同样,全身振动疗法也日益成为缓解肌肉紧张和强化骨骼的流行方法[3]。当前研究正致力于在细胞工程领域的更小层面上探索这些方法的应用潜力。骨细胞作为骨基质中主要的细胞类型,能够将机械信号转化为生化信号,驱动机械载荷诱导的骨形成[4]。研究进一步表明,振动效应可以优化细胞营养输运与氧气供应,促进各种类型细胞生长[5]。一个有趣的问题是,控制振动是否能够通过改变正常细胞和癌细胞的命运来纠正病理状态。
3 iPS细胞和iTS细胞中细胞命运的改变
在细胞工程领域中,诱导性多能干细胞(iPS)和诱导性肿瘤抑制(iTS)细胞(iTS细胞)是显著改变细胞命运的两个例子。在iPS细胞中,cMyc、Klf4、Oct4及Sox2四转录因子通过其非凡的重编程能力,将终末分化细胞逆转为类胚胎干细胞的原始多能态,重现发育全能性[6]。此项突破在再生医学领域彰显巨大的潜力,为衰老细胞功能重建与损伤细胞原位再生点燃希望。iTS细胞的制备过程则呈现反常识的方法。传统抗癌策略聚焦于抑制原癌基因及其下游信号传导网络以实现肿瘤清除。相反,iTS细胞技术则通过精准激活特定致癌信号通路来清除肿瘤(图1)[7]。值得注意的是,特定因子(如cMyc或Oct4)的激活可促使细胞向iTS细胞转化。cMyc或Oct4的增加可以诱导iTS细胞的生成,这一意外发现成为该领域的又一重要里程碑。这一发现表明,通常认为的与促进肿瘤生长相关的基因,在某些特定情况下可能会促使细胞生成并释放具有抑制肿瘤作用的蛋白质。iPS细胞和iTS细胞的生成表明细胞行为的可塑性与适应性。为充分挖掘iTS细胞的治疗潜力,同时降低操纵致癌基因的潜在风险,生物力学与细胞工程学领域的研究人员或可借助机械刺激的潜力来实现这一目标。
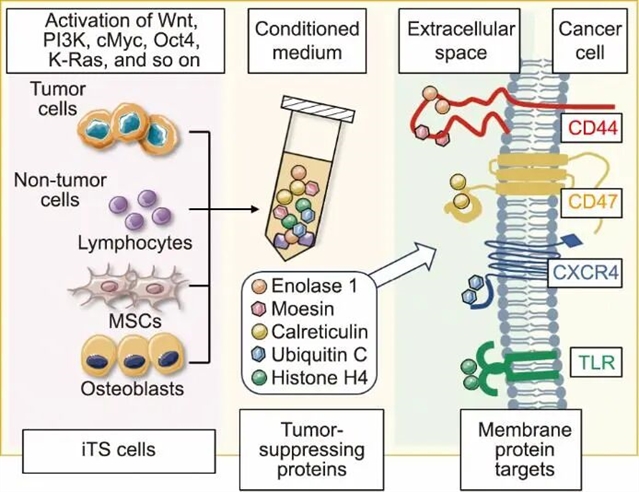
图1 诱导性肿瘤抑制(iTS)细胞的生成。Wnt、Pl3K、PKA等致癌信号通路的激活以及cMyc、Oct4、K-Ras等基因的过表达,将肿瘤细胞(如乳腺癌细胞、前列腺癌细胞、胰腺癌细胞、骨肉瘤细胞)和非肿瘤细胞[如淋巴细胞、间充质干细胞(MSC)、成骨细胞]转化为iTS细胞。iTS细胞产生并分泌肿瘤抑制蛋白(如烯醇化酶1、膜突蛋白、钙网蛋白、泛素C和组蛋白H4),这些蛋白在条件培养基中显著富集。这些肿瘤抑制蛋白通过与肿瘤相关蛋白靶点,如CD44、CD47、CXCR4及Toll样受体(TLR)相互作用,抑制肿瘤细胞进展。经许可转载自参考文献[7]。
4 通过振动生成iTS细胞
肿瘤细胞和非肿瘤细胞的生长和分化受各种因素的调控。当前研究集中于通过外界环境刺激(尤其是机械刺激)生成类似iPS细胞刺激触发而获得的多能性(STAP)细胞。然而,迄今为止,尚无成功制备STAP细胞的确凿证据 [8]。相比之下,iTS细胞领域已取得具有前景的研究进展。生物医学工程研究人员已获得确凿数据表明,某些肿瘤细胞(如乳腺癌细胞)通过响应低强度振动(如10 Hz频率在地球重力加速度下持续0.5~1.0 h)抑制迁移行为[9]。一个引人关注的科学问题由此产生:振动能否诱导非肿瘤细胞,如间充质干细胞(MSC,一种骨细胞与肌细胞的前体细胞)和淋巴细胞(一种参与免疫应答的血细胞),向iTS细胞转化?近期针对小鼠与人类细胞的实验研究使学术界对这一前景充满希望[10](图2)。
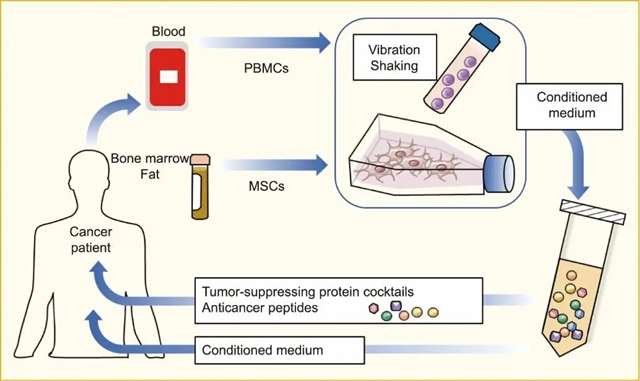
图2 振动处理后的肿瘤抑制细胞的应用及其条件培养基。作为癌症治疗的一种新选择,iTS细胞可从癌症患者血液中的外周血单核细胞(PBMC)以及患者骨髓或脂肪组织中的MSC中生成。通过振动将PBMC和MSC转化成iTS细胞后,它们的培养基(条件培养基)或肿瘤抑制蛋白及其活性片段(抗癌多肽)可用于癌症患者的施治。
新证据表明,连接细胞膜、细胞骨架以及核膜的错综复杂连接的结构纤维,或可成为将机械振动传递到细胞核内染色质的通道。而在触发导致抑制肿瘤蛋白产生和随后分泌的复杂级联过程中,这种传递机制似乎扮演着关键角色[9]。此外,基于质谱的蛋白质组学分析的最新进展表明,在iTS细胞中,关键肿瘤抑制蛋白持续富集。值得注意的是,在iTS细胞制备的各种途径中,均发现组蛋白H4等蛋白质的存在,这表明这些蛋白在特化细胞的抗癌特性中发挥着重要作用[10]。
5 振动疗法联合免疫治疗
振动疗法或许为当前的癌症治疗开启新的维度。该疗法具有双重益处:既可直接作用于癌细胞发挥抗癌效应,又能通过从癌症患者体内获取的非癌细胞(如免疫细胞)间接增强治疗效果。经振动处理的iTS细胞的具体应用是将其与嵌合抗原受体(CAR)-T细胞免疫疗法联动[11]。CAR-T疗法是指从癌症患者体内采集T细胞,通过基因工程技术产生一种名为CAR的特异性受体。这种经改造的CAR分子对癌细胞具有高亲和力。虽然T细胞作为免疫系统的组成部分本身就具有清除癌细胞的功能,但CAR的引入能够引导其精准识别并攻击癌细胞,从而显著提升其抗癌效能。
除了MSC,本研究还纳入CAR-T细胞疗法的关键组分——T淋巴细胞,旨在探究二者联用对肿瘤抑制的协同效应。我们采用常规试管振荡器模拟相当于1倍地球重力加速度环境的结果显示,源自T细胞培养液的蛋白质对抑制乳腺癌细胞的代谢活性和迁移能力表现出显著功效。本研究重点关注培养基黏度的影响,常规培养基的黏度测定值为0.8 cP(1 cP = 10-3 Pa·s-1)。为增强其抗肿瘤效力,我们通过添加甲基纤维素将培养基黏度提升至10.0 cP。当前亟待解答的关键科学问题是机械刺激是否既能诱导T细胞向iTS细胞转化,又能同步激活T细胞功能。这一潜在途径可通过利用靶向T细胞表面受体的抗体实现,对调控肿瘤微环境中的免疫平衡具有深远影响。若机械刺激被证实具有显著激活T细胞的效力,则基于此技术开发的免疫疗法有望为靶向肿瘤治疗带来革命性突破。已有令人鼓舞的研究证据表明,采用超声波(一种通常为20 kHz以上频率的机械刺激形式)的研究便是一项典型例证[12]。
经过振动处理的iTS细胞与CAR-T细胞协同疗法引发学界高度期待,二者联用可能实现更全面的抗肿瘤效应。具体而言,CAR-T细胞通过抗原特异性识别机制直接杀伤癌细胞,而iTS细胞则通过分泌肿瘤抑制蛋白展现出抑制肿瘤生长的潜力。值得注意的是,CAR-T细胞需要直接接触发挥作用,但iTS细胞可以间接发挥作用。我们认识到,CAR-T细胞治疗面临抗原逃逸和免疫抑制肿瘤微环境等挑战,而iTS细胞可通过调控肿瘤生长的多维度进程提供互补性治疗效益。此外,经过工程化改造的iTS细胞或可精准靶向肿瘤微环境中的特定生物学特征,从而有望提升整体治疗效能。
6 前景展望
当前,癌症治疗体系涵盖多种干预策略,主要包括外科手术、化疗、放疗、靶向治疗、免疫治疗等核心疗法,以及手法按摩和体能锻炼等辅助措施,可针对局部病灶或全身性调控发挥作用。一个核心科学问题由此浮现:对患者来源细胞实施振动处理,能否为传统癌症治疗带来新的维度?虽然机械刺激可以改变癌细胞的行为,使其暂时缩小,然后在几小时内恢复到正常状态,并对不同类型癌症的生长抑制产生不同影响,但机械刺激的主要目标不是癌细胞,而是MSC和T细胞等抗癌细胞。除振动处理外,其他形式的生物物理刺激(包括电激发、超声和光照射)都可能触发机械转导机制,改变癌细胞发展进程,同时增强非癌性细胞的抗癌效能[11–12]。为了深入探究这一前景,对分子信号进行彻底的分析势在必行。了解机械转导在共振频率下是否达到最佳效果,以及评估黏性细胞培养基如何增强这些细胞中的响应,是至关重要的研究问题。解决这些问题有望推进由机械力驱动的iTS细胞介导的癌症治疗的发展。
参考文献:
[1]Wang N. Review of cellular mechanotransduction. J Phys D Appl Phys 2017; 50 (23):233002.
[2]Liu SL, Qi W, Li H, Wang YF, Yang XF, Li ZM, et al. Recent advances in massage therapy—a review. Eur Rev Med Pharmacol Sci 2015; 19(20):3843-9.
[3]Kiel DP, Hannan MT, Barton BA, Bouxsein ML, Sisson E, Lang T, et al. Low magnitude mechanical stimulation to improve bone density in persons of advanced age: a randomized, placebo-controlled trial. J Bone Miner Res 2015; 30(7):1319-28.
[4]Qin L, Liu W, Cao H, Xiao G. Molecular mechanosensors in osteocytes. Bone Res 2020; 8:23.
[5]Bas G, Loisaae S, Hudon SF, Woods K, Hayden EJ, Pu X, et al. Low intensity vibrations augment mesenchymal stem cell proliferation and differentiation capacity during in vitro expansion. Sci Reports 2020; 10:9369.
[6]Yamanaka S. Pluripotent stem cell-based cell therapy—promise and challenges. Cell Stem Cell 2020; 27(4):523-31.
[7]Li K, Huo Q, Li BY, Yokota H. Three unconventional maxims in the natural selection of cancer cells: generation of induced tumor-suppressing cells ( iTSCs). Int J Biol Sci 2023; 19(5):1403-12.
[8]De Los AA, Ferrari F, Fujiwara Y, Mathieu R, Lee S, Lee S, et al. Failure to replicate the STAP cell phenomenon. Nature 2015; 525:E6-9.
[9]Yi X, Wright LE, Pagnotti GM, Uzer G, Powell KM, Wallace JM, et al. Mechanical suppression of breast cancer cell invasion and paracrine signaling to osteoclasts requires nucleocytoskeletal connectivity. Bone Res 2020; 8:40.
[10]Xiong X, Huo Q, Li K, Cui C, Chang C, Park C, et al. Enhancing anti-tumor potential: low-intensity vibration suppresses osteosarcoma progression and augments MSCs’ tumor-suppressive abilities. Theranostics 2024; 14:1430.
[11]Huang K, Liu L, Huang Y, Wang Y, Zhou Y, Han G, et al. Remote control of cellular immunotherapy. Nat Rev Bioeng 2023; 1:440.
[12]Wu Y, Liu Y, Huang Z, Wang X, Jin Z, Li J, et al. Control of the activity of CAR-T cells within tumours via focused ultrasound. Nature Biomed Eng 2021; 11:1336.
引用本文:
Hiroki Yokota, Bai-yan Li. Exploring Shaking for Cancer Treatment. Engineering, 2024, 40(9): 12–14. DOI: 10.1016/j.eng.2024.04.001
更多内容
天然药物靶向DNA G-四链体:癌症治疗新策略
苦木素类化合物抗癌研究新进展:天然产物的抗癌潜力再受关注
纳米技术为肺癌治疗带来新希望
研究发现甲状腺肿瘤组织存在菌群失调或与甲状腺乳头状癌发生相关
《Engineering》发布“2025全球十大工程成就”
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。