|
|
|
|
|
当AI遇见下一代生物材料——通过最大化氢键计算设计超稳定蛋白质 |
|
|
在合成生物学与先进材料研究的交汇地带,科学家长期致力于开发性能优于天然蛋白质的人工蛋白质体系。自然界中存在的肌联蛋白与蜘蛛丝蛋白等物质,通过其内部精密的β-折叠结构和高效的氢键作用,展现出卓越的力学性能与结构稳定性,为人工蛋白质设计提供了重要灵感。基于这一思路,南京大学郑鹏教授课题组突破传统设计方法,建立了一套结合人工智能预测与分子动力学验证的计算设计平台。利用该平台,团队成功设计出新型蛋白质“SuperMyo”,其氢键网络得到显著优化,在机械强度与热稳定性方面均实现了对天然模板的超越,为发展适用于极端条件的新型生物材料奠定了坚实基础。2025年11月18日,相关研究成果以“Computational design of superstable proteins through maximized hydrogen bonding”为题,发表在Nature Chemistry期刊上。
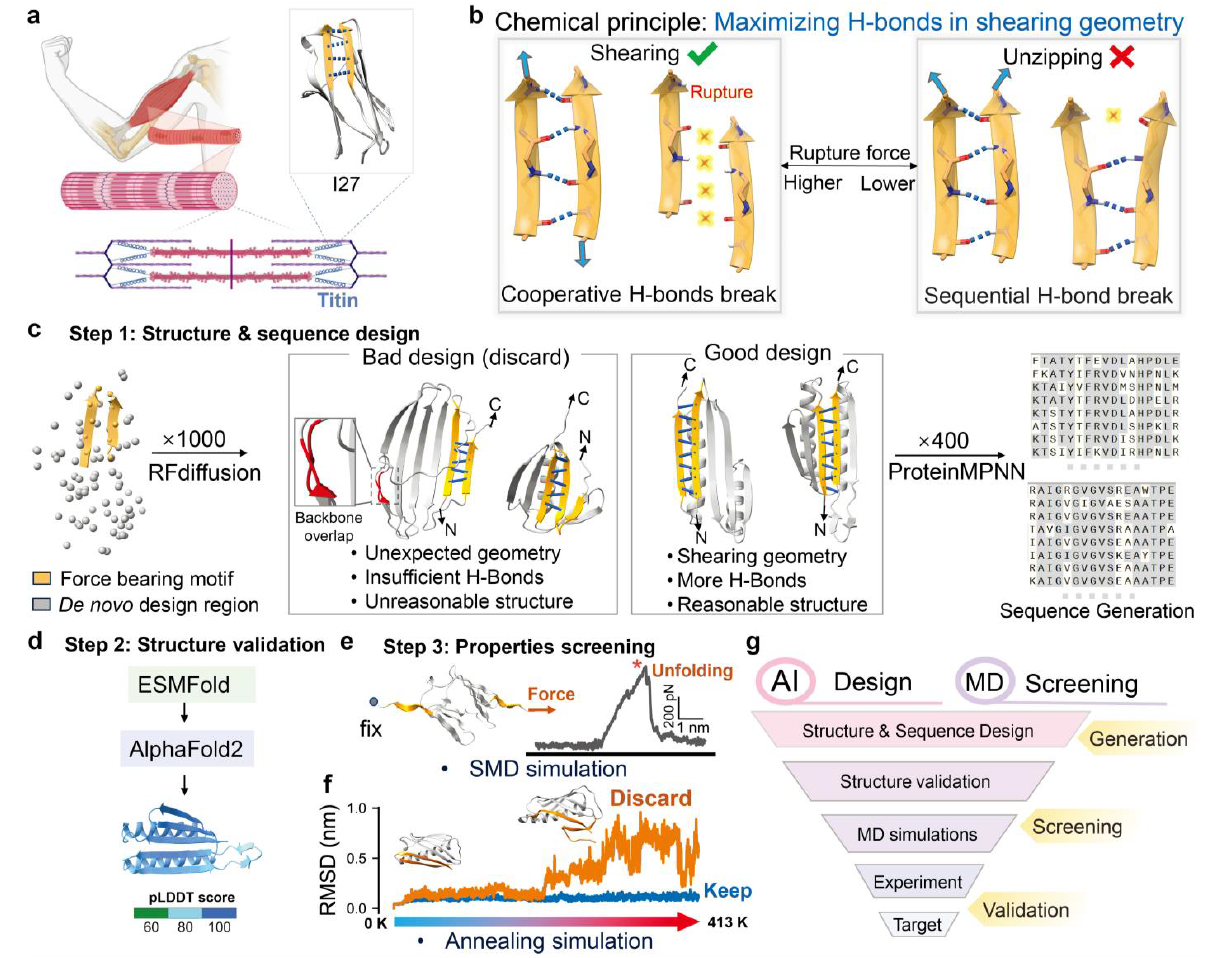
图1:AI与物理模型联姻,构建蛋白质设计新范式。
该研究的核心突破在于建立了一个高效、理性的蛋白质设计新范式。该流程始于一个明确的化学物理原理:通过增加受力β-折叠片中的主链氢键数量,并确保其在“剪切”受力模式下协同断裂,可大幅提升蛋白质的机械稳定性。为此,团队构建了一个无缝衔接的计算管道:首先,利用扩散模型RFdiffusion以天然肌联蛋白I27结构域为蓝图,生成具有延长β-链的全新蛋白质骨架。随后,通过逆折叠工具ProteinMPNN设计出能折叠成目标骨架的氨基酸序列。最后,借助AlphaFold2/ESMFold的结构预测能力和分子动力学模拟的物理评估,对上万种候选设计进行机械强度与热稳定性的高效筛选。这套“AI生成-物理筛选”的闭环系统,将数据驱动的创造性与理论驱动的严谨性深度融合,实现了从化学原理到蛋白质结构的精准定向进化。
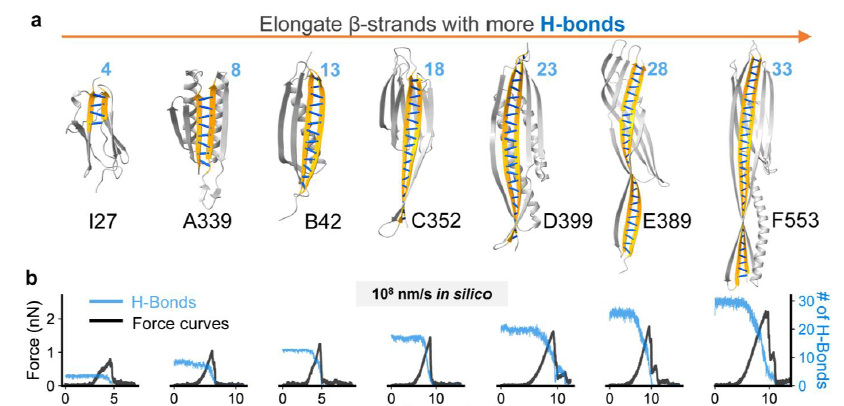
图2:性能的阶梯式跨越,突破天然蛋白质的稳定极限。
通过上述流程,研究团队不仅一次性获得了性能提升的蛋白质,更成功地进行了多轮迭代设计。他们系统地将受力β-链中的氢键数量从天然I27的4个,逐步增加至33个,相应开发了从A到F的SuperMyo蛋白系列。
单分子力谱实验结果表明,蛋白质的机械强度与氢键数量呈现出清晰的线性正相关关系。最终,性能最强的SuperMyo-F553蛋白的展开力达到了1050 pN,是天然蛋白的四倍以上,成功进入了纳牛顿级别,这是许多天然最坚韧蛋白质才能达到的领域。
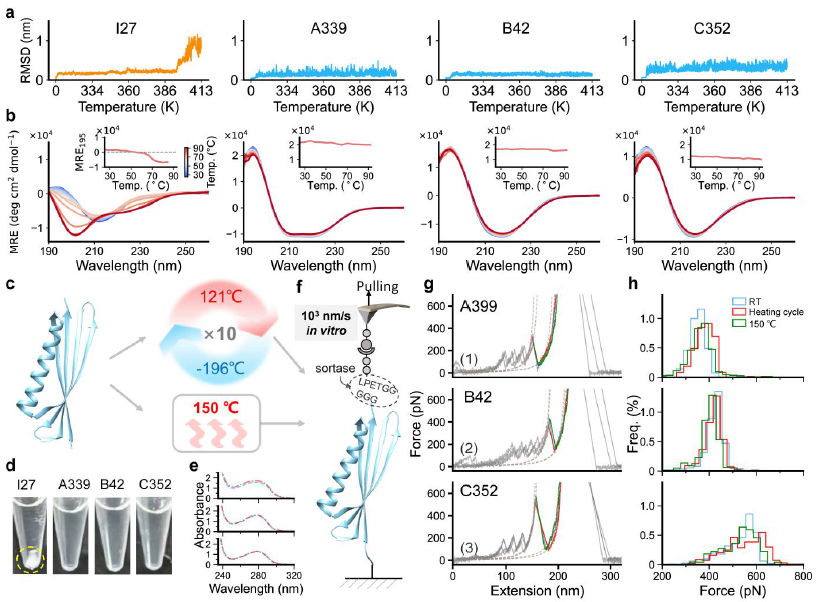
图3:超越机械稳定,挑战极端热环境。
除了超凡的机械强度,SuperMyo还展现出卓越的热稳定性。分子动力学模拟显示,这些蛋白在模拟的413K(140°C)高温下结构依然稳定。实验验证更是令人印象深刻:经过121°C(标准高压灭菌温度)的反复热循环,甚至150°C长达1小时的极端处理,SuperMyo蛋白不仅在水溶液中保持可溶、未发生聚集沉淀,其单分子机械性能也几乎未受损伤。这意味着,研究组在分子层面赋予的稳定性,能够帮助蛋白质在真实世界的极端物理化学条件下维持其结构与功能,这是走向实际应用的关键一步。
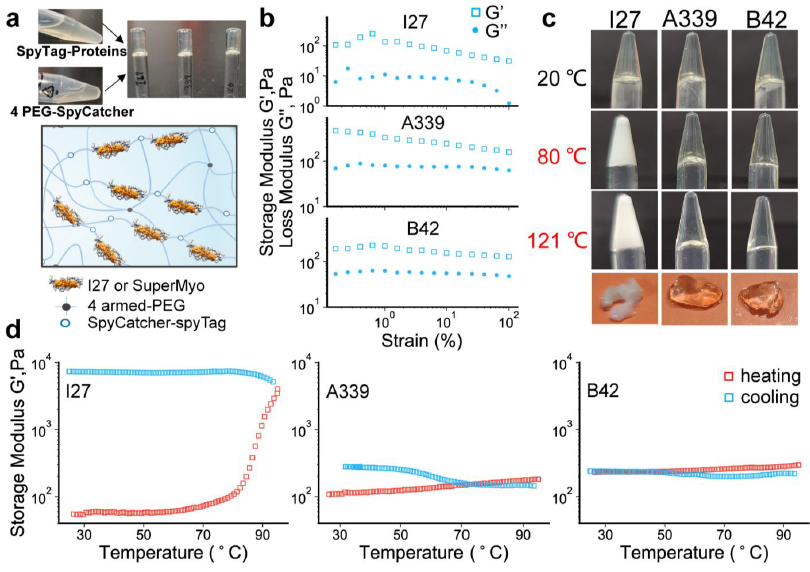
图4:从分子到宏观,构筑未来生物医学的坚实地基。
研究的终极价值在于应用。为了证明SuperMyo的实用潜力,团队将其作为交联单元,通过高效的SpyTag-SpyCatcher反应,构建了蛋白质水凝胶。宏观性能测试结果与分子层面的发现一脉相承:由天然I27构成的水凝胶在80°C左右即变性、浑浊并失去弹性;而由SuperMyo(如A339, B42)构成的水凝胶,在121°C的高温下仍能保持透明外观和稳定的凝胶态。这种与工业灭菌流程直接兼容的特性,极大地拓宽了蛋白质材料在生物医学领域的应用场景,例如可作为可植入的耐灭菌组织工程支架或在高温环境下工作的生物传感器。
总结与展望:开启“按需定制”生物材料的时代
本项研究的意义远不止于创造了几种超稳定的蛋白质,它更在方法论和应用层面提供了深刻的启示:
1 原理驱动与AI赋能的成功融合:它证明了将基础的化学物理原理(氢键最大化与剪切几何)与先进的AI设计工具相结合,能够理性地创造出性能超越自然的生物大分子。
2 打通了从分子设计到宏观材料性能的路径:研究清晰地展示了如何在分子、单分子、宏观材料等多个尺度上实现性能的协同与传递,为“从分子出发”的材料设计提供了完整且成功的范例。
3 为面向极端环境的生物技术奠定基础:无论是用于地外探索、深海作业还是体内植入的苛刻环境,对生命元件的稳定性都提出了极高要求。SuperMyo的出现,为我们设计和制造能在这些极端条件下正常工作的蛋白质器件和材料提供了全新的核心组件与设计蓝图。
总而言之,这项工作不仅将蛋白质的稳定性能推向了新的高峰,更重要的是,它提供了一套可扩展、可推广的设计框架,预示着我们将进入一个能够“按需定制”高性能生物材料的新时代。该研究标志着郑鹏课题组在蛋白质AI设计领域长期探索的又一结晶。团队近年来致力于发展交叉学科方法,已在一系列高水平期刊(如 CCS Chem. 7, 1629-1640 (2025); ACS Nano 19, 38077-38085 (2025); eLife: doi: https://doi.org/10.1101/2025.11.03.686355)上报道了多种超稳定蛋白质设计成果,逐步构建起“从化学原理到计算设计,再到材料应用”的全链条研究范式。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-025-01998-3