|
|
|
|
|
【南京理工大学陈钱、左超教授团队】 “无像差”定量相位成像:基于环形差分相衬照明的定量“相位-像差”联合重建 |
|
|
生物细胞在可见光波段呈现近似透明的弱吸收特性,导致传统明场显微镜下细胞与周围介质间的光学对比度极低。为增强成像对比度,常规方法需依赖化学染色或荧光标记引入外源性吸收/荧光探针实现细胞结构的可视化。然而,这些方法存在光毒性、光漂白以及生物兼容性不足等缺点,严重限制活细胞长时程动态观测。定量相位成像(quantitative phase imaging, QPI)利用细胞自身物理特性相位(厚度)作为内源性“探针”,以纳米级精度解析细胞厚度、折射率以及三维形貌[1-3],为活细胞动态观测及纳米尺度生物学研究开辟了新途径。
作为QPI技术的重要分支,差分相衬成像(differential phase contrast, DPC)因其非干涉、低成本的优势备受关注[4-5]。然而,其理论框架建立在“弱物体近似”基础之上,通过线性模型关联强度图像与样本相位,这种简化模型导致两个局限:其一,相位重建结果高度依赖理想光瞳下相位传递函数的精确建模,而实际光学系统的波前畸变会与样品相位耦合,导致严重的重建误差;其二,传统半圆形照明模式受限于相位传递响应抵消问题,造成低频相位信息缺失,难以准确重建弱相位物体的精细结构。上述局限性显著削弱了DPC技术在非理想光学环境中的抗干扰能力,导致其在细胞形貌表征、亚细胞动态过程追踪等前沿生物学研究中的实际应用范围受到严格制约。

图1 系统像差对相位成像的影响
在该项工作中,南京理工大学陈钱、左超教授团队提出了环形照明像差校正差分相衬定量相位成像方法(artifact-free aberration-corrected DPC,ACDPC),采用迭代相位恢复算法从原始强度中联合重建样本相位和系统像差,克服传统方法的像差敏感缺陷,实现自动像差检测/校正的高质量定量相位成像,为复杂光学系统下的生物高精度定量相位分析提供了新途径。
ACDPC构建了基于环形照明的相位-像差联合重建框架,通过匹配物镜数值孔(NAill=NAobj)的环形优化照明[6-7],实现包含像差光瞳下相位传递函数的全频带响应优化,缓解了传统半圆形照明下物体低频信息缺失问题。提出模拟退火回火与正则化约束的联合反演算法,结合自适应自然指数衰减策略,通过强度残差的最小化同时检索系统像差和物体相位,无需任何先验有效克服了差分相衬成像对系统像差敏感的固有局限。研究团队证明三帧环形照明模式即可满足相位-像差联合重建所需的数据约束,相较于传统DPC所需的4帧数据,ACDPC缩短了图像采集时间,同时实现了高相位灵敏度的“无像差”高质量定量相位成像。

图2 ACDPC迭代重建联合优化算法流程图。(a)基于半环形照明的ACDPC成像系统;(b)三种环形照明模式及其强度图像;(c) ACDPC重建流程图
仿真和实验验证了所提出的方法对复杂像差具有鲁棒性,实现了高保真定量相位重建。基于USAF-1951分辨率靶的定量测试表明,ACDPC在±10 μm离焦范围内可实现345 nm的理论极限分辨率(达非相干衍射极限),相较于传统DPC方法相位保真度显著提升。即使在大离焦(+20 μm)下,重建结果仍显著优于传统DPC,证实其对大像差下的相位重构具有强鲁棒性。

图 3 USAF分辨率目标实验。(a)基于商用倒置显微镜的环形照明ACDPC实验系统;(b)实际获取的强度图像和感兴趣区域(ROI 1)的放大图像;(c) DPC和ACDPC在-10 μm离焦下的全视场重建相位和放大图像(ROI 1),以及定量相位剖线;(d) DPC和ACDPC 在+10 μm离焦下的重建相位和放大图像(ROI 2);(e) +20 μm离焦下DPC和ACDPC的重建相位以及像差系数
为了验证ACDPC对于生物细胞样品的成像性能,研究人员采用NIH 3T3细胞样品进行对照实验。通过两次手动聚焦对同一样本不同区域引入不同程度的未知离焦像差。实验结果表明,两组像差下ACDPC方法均可清晰重构脂滴及细胞间隙等亚细胞结构,消除了传统DPC方法中因像差耦合产生的边缘模糊及亚细胞结构伪影。上述结果说明,ACDPC能够准确分离样本相位与未知系统像差,且对不同类型像差分布具有稳定检索能力。
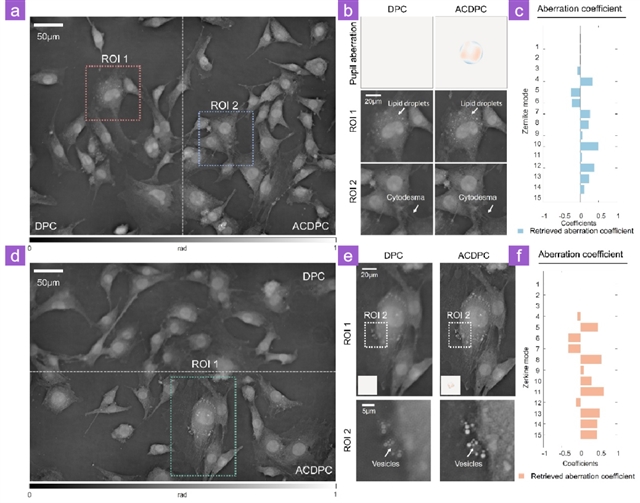
图 4 DPC和ACDPC在NIH 3T3细胞上的实验结果。(a)在精细聚焦条件下对NIH 3T3细胞样本进行DPC和ACDPC实验的结果;(b)图(a)中两个感兴趣区域(ROI 1、ROI 2)的放大图像;(c)图(b)中重建像差的Zernike系数;(d)在粗聚焦条件下对NIH 3T3细胞样本进行DPC和ACDPC实验的结果;(e)图(a)中ROI (ROI 1)的放大图像及其感兴趣区域(ROI 2)的放大图像;(f)图(e)中重建像差的Zernike系数
为进一步评估ACDPC方法在动态活细胞成像中的性能表现,研究团队对体外培养的Hela细胞进行了2 h像差校正相位重建。如图5所示,在传统DPC下,由于系统温漂或机械振动引起的动态波前像差导致重建相位中出现显著伪影及亚细胞结构细节丢失。ACDPC方法通过三帧图像动态校正像差,实现了时变波前像差的在线估计与补偿,解析出细胞伪足在增殖过程中的收缩-扩张动态过程,在长时间活细胞观测中展现出的高鲁棒性和可靠性。

图 5 体外培养的Hela细胞的2 h的动态像差校正相位成像结果
ACDPC方法通过环形优化照明与相位-像差联合重建算法,仅需三幅强度图像实现系统像差与物体相位的有效解耦,有效克服了传统差分相衬成像对系统像差敏感的难题,显著提升复杂光学系统下定量相位成像分辨率和鲁棒性,有望为活细胞动态过程的高精度相位定量分析提供了高鲁棒性技术方案。
该工作以“Aberration-corrected differential phase contrast microscopy with annular illuminations”为题发表在Opto-Electronic Science 2025年第8期,并被选为封面文章。
【基金支持】该工作得到了国家自然科学基金项目(62305162,62227818,62361136588)、中国博士后科学基金项目(2023TQ0160,2023M731683)、国家重点研发计划项目(2024YFE0101300)的资助、 江苏省科技计划生物医药竞争类项目(BE2022847)、江苏省科技计划重点国别产业技术研发合作项目(BZ2022039)、中央高校基础科研业务费专项资金资助项目(2023102001)等支持。
研究团队简介
南京理工大学智能计算成像实验室(SCILab: www.scilaboratory.com)隶属于南京理工大学光学工程国家一级重点学科带头人陈钱教授领衔的“光谱成像与信息处理”教育部长江学者创新团队、首批“全国高校黄大年式教师团队”。实验室学术带头人左超教授为教育部长江学者特聘教授、国际光学工程学会会士(SPIE Fellow)、美国光学学会会士(Optica Fellow)、英国物理学会会士(IOP Fellow),入选科睿唯安全球高被引科学家。实验室致力于研发新一代计算成像与传感技术,在国家重大需求牵引及重点项目支持下开展新型光学成像的机理探索、工程实践以及先进仪器的研制工作,并开拓其在生物医药、智能制造、国防安全等领域的前沿应用。研究成果已在SCI源刊上发表论文290余篇,其中50篇论文被选作PhotoniX、Light、Optica、LPR等期刊封面论文,30篇论文入选ESI高被引/热点论文,论文被引近2万次。获中国光学工程学会技术发明奖一等奖、江苏省科学技术奖基础类一等奖、日内瓦国际发明展“特别嘉许金奖”等。培养研究生6人获全国光学工程优秀博士论文/提名奖,5人获中国光学学会王大珩光学奖,13人入围Light全国光学博士生学术竞赛全国百强,获“挑战杯”、“创青春”、“研电赛”全国金奖十余次,“互联网+”全国总冠军。师生双创事迹得到央视《焦点访谈》、人民网、新华网、光明日报、中国教育电视台等百余家媒体报道,社会辐射影响广泛。
南京理工大学智能计算成像实验室团队合照
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。