2025年10月1日,天津大学医学院、先进医用材料与医疗器械全国重点实验室姬晓元团队于Chem期刊在线发表题为“Modular train-style nanorobots for targeted deep penetration and multi-directional collaborative treatment of colorectal cancer”的研究成果。该研究通过构建“列车式”模块化纳米机器人体系,将外泌体靶向、光驱动推进、异质结催化有机整合,实现了对结直肠癌的精准靶向、深层穿透、免疫-代谢双重重塑,在原发与转移结直肠癌模型中展现出显著的抑瘤和免疫激活作用,为复杂实体瘤的多维度协同治疗提供了全新范式。论文通讯作者是姬晓元教授;第一作者是博士研究生叶镓闽和范月月。
结直肠癌是全球第三大常见恶性肿瘤,死亡率居高不下。当前的治疗模式面临两大挑战:一是肿瘤组织中致密的细胞外基质与巨大的间质压力阻碍药物深层渗透;二是肿瘤糖酵解产生的乳酸过度积累营造免疫抑制微环境,使肿瘤细胞逃避免疫监视。如何突破“物理屏障+免疫抑制”这双重困境,是提升结直肠癌治疗效果的关键科学问题。
在这项工作中,天津大学姬晓元教授团队提出并制造了一种新颖的“列车式”纳米机器人系统。该体系借鉴列车编组的功能分工理念,通过合理的模块组合,实现了对结直肠癌的精准靶向、深层渗透、多模态催化与免疫代谢重塑的协同作用,为复杂实体瘤的综合治疗提供了新的策略。这类纳米机器人由三部分模块组成,各司其职而又紧密协作:中性粒细胞来源的外泌体被设计为“车头”,具备炎症趋化和肿瘤靶向能力,并在表面修饰三苯基膦,实现对肿瘤线粒体的精准定位;Pd-Cu7S4异质结构成“车体”,在近红外光照下分离电子和空穴,从而高效产生活性氧并伴随谷胱甘肽耗竭和NADH氧化,直接破坏肿瘤细胞的氧化还原平衡,同时,该过程促进铜离子在线粒体内的聚集诱发铜死亡;Cu7S4非对称结构则充当“车尾”,在近红外光照下形成温度梯度,从而产生热泳驱动,为纳米机器人提供主动推进力,使其能够突破致密基质屏障并深入肿瘤核心区域。该设计的最大创新性在于靶向牵引力与光驱推动力的直线性整合,实现了能量最大化利用,为体内物理屏障跨越和实体瘤深层渗透提供最大动力。
值得注意的是,该团队还开发了口服递送策略,以提高治疗的适用性。通过3D打印和光固化工艺,构建了由明胶甲基丙烯酰化物(GelMA)核心与海藻酸钙外壳组成的肠溶微胶囊。该胶囊能够在胃液环境下保持稳定,在肠道条件下实现可控释放,既保护了纳米机器人免受胃酸破坏,又帮助其跨越肠道黏液屏障,从而高效到达肿瘤病灶。动物实验进一步验证了口服纳米机器人胶囊的疗效,其在结直肠癌原位模型中表现出与静脉注射相当的肿瘤抑制作用,同时有助于恢复肠道菌群的多样性。
这项工作不仅拓展了纳米机器人在复杂实体瘤治疗中的应用边界,也为推动多维度协同治疗平台的建立提供了新思路。通过材料科学、纳米技术与肿瘤免疫学的深度融合,该研究展示了化学在医学前沿中的独特价值和广阔前景。
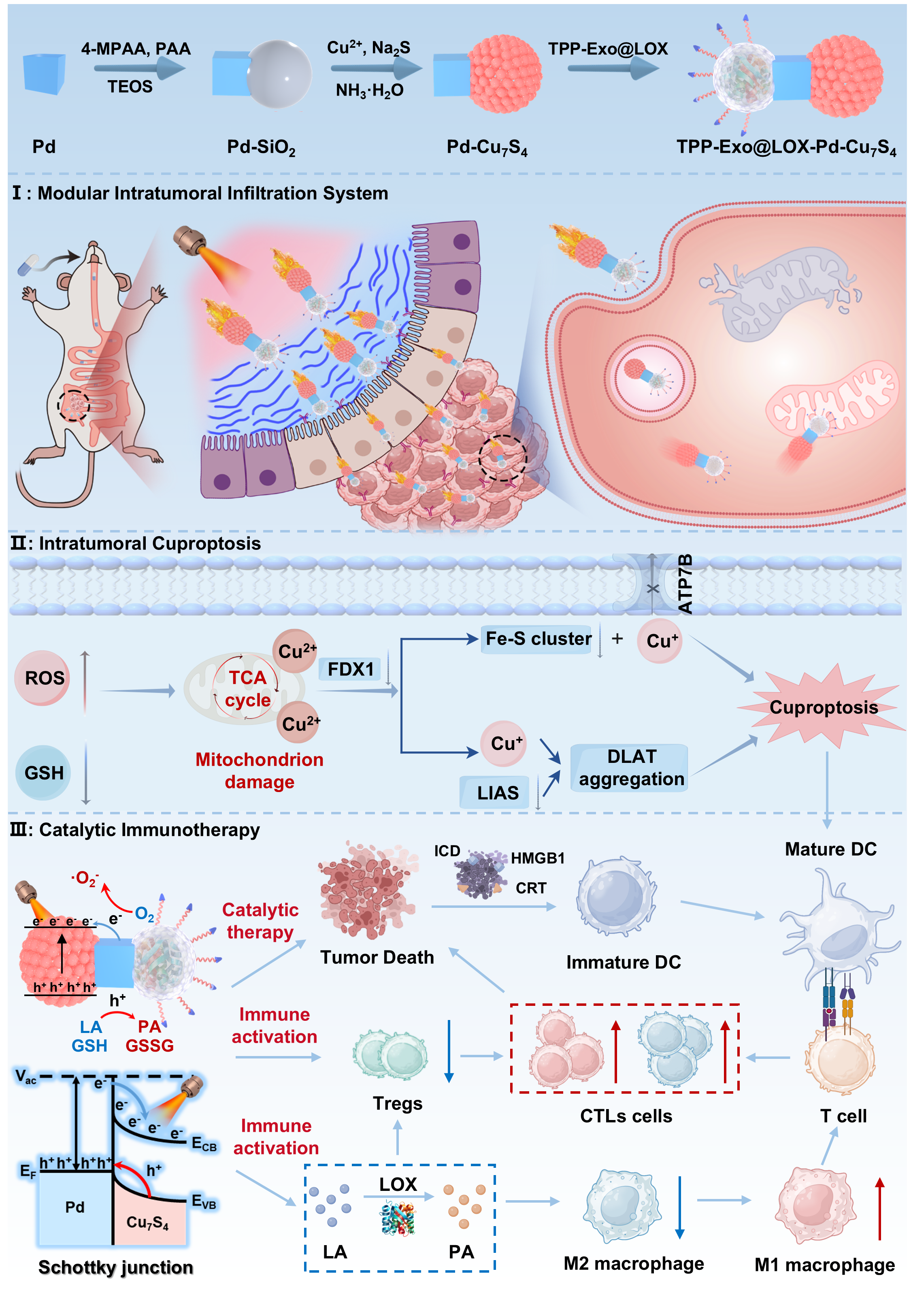
图1:纳米机器人的制备流程以及抗肿瘤机制的示意图。

图2:乳酸与铜死亡相关指标的生信分析与纳米机器人的制备以及性能表征。
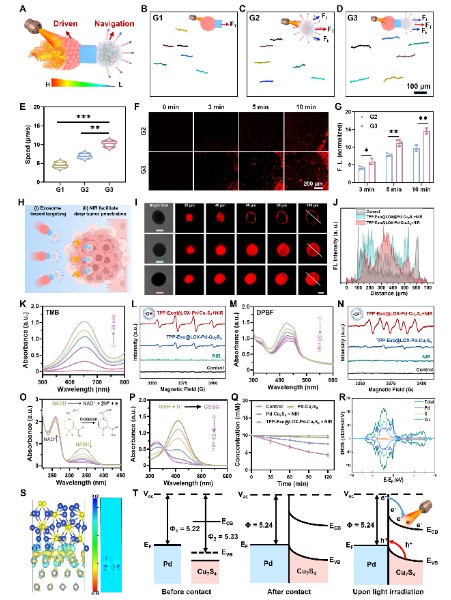
图3:纳米机器人的运动以及催化性能与机理。
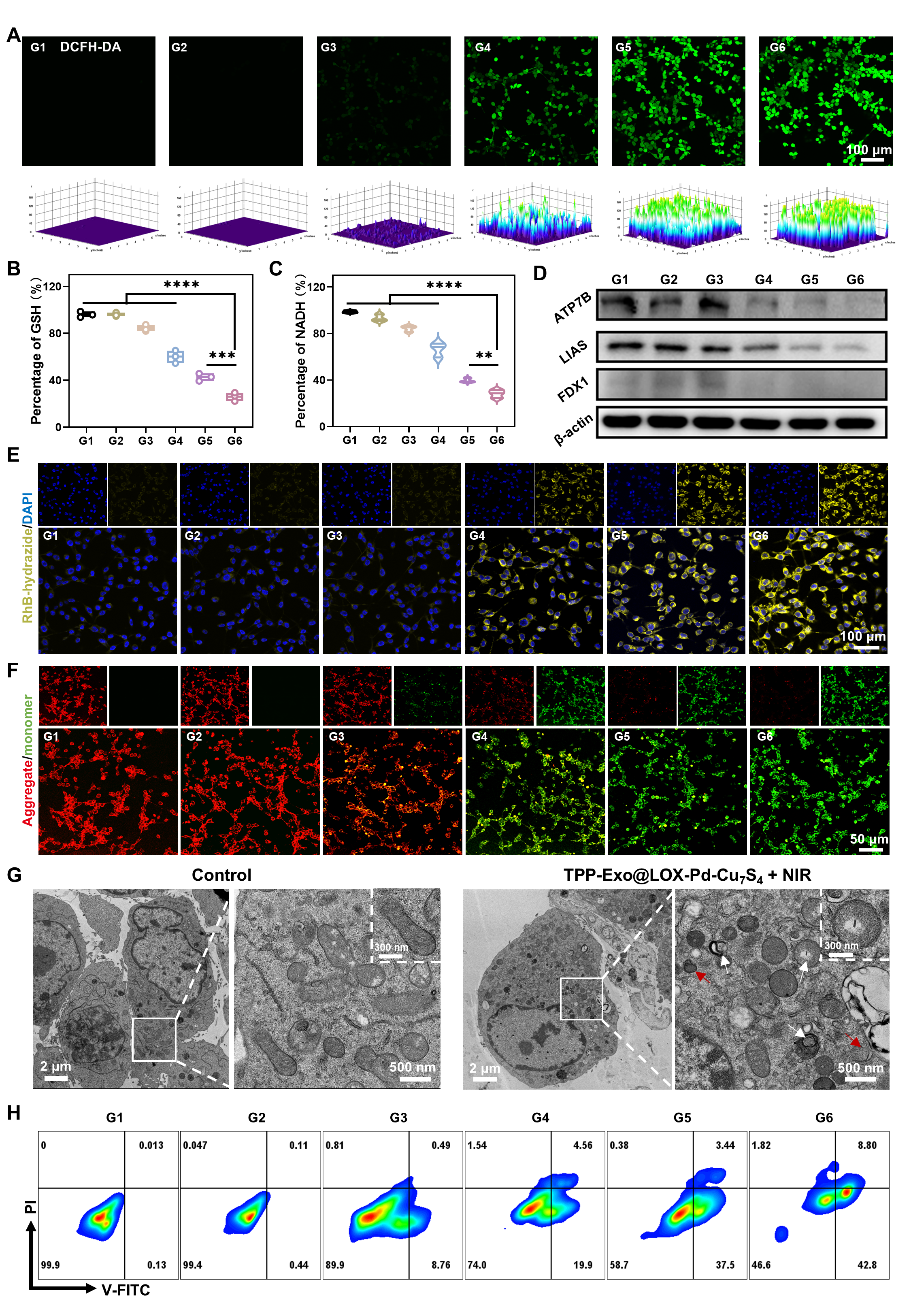
图4:纳米机器人体外抗肿瘤性能。
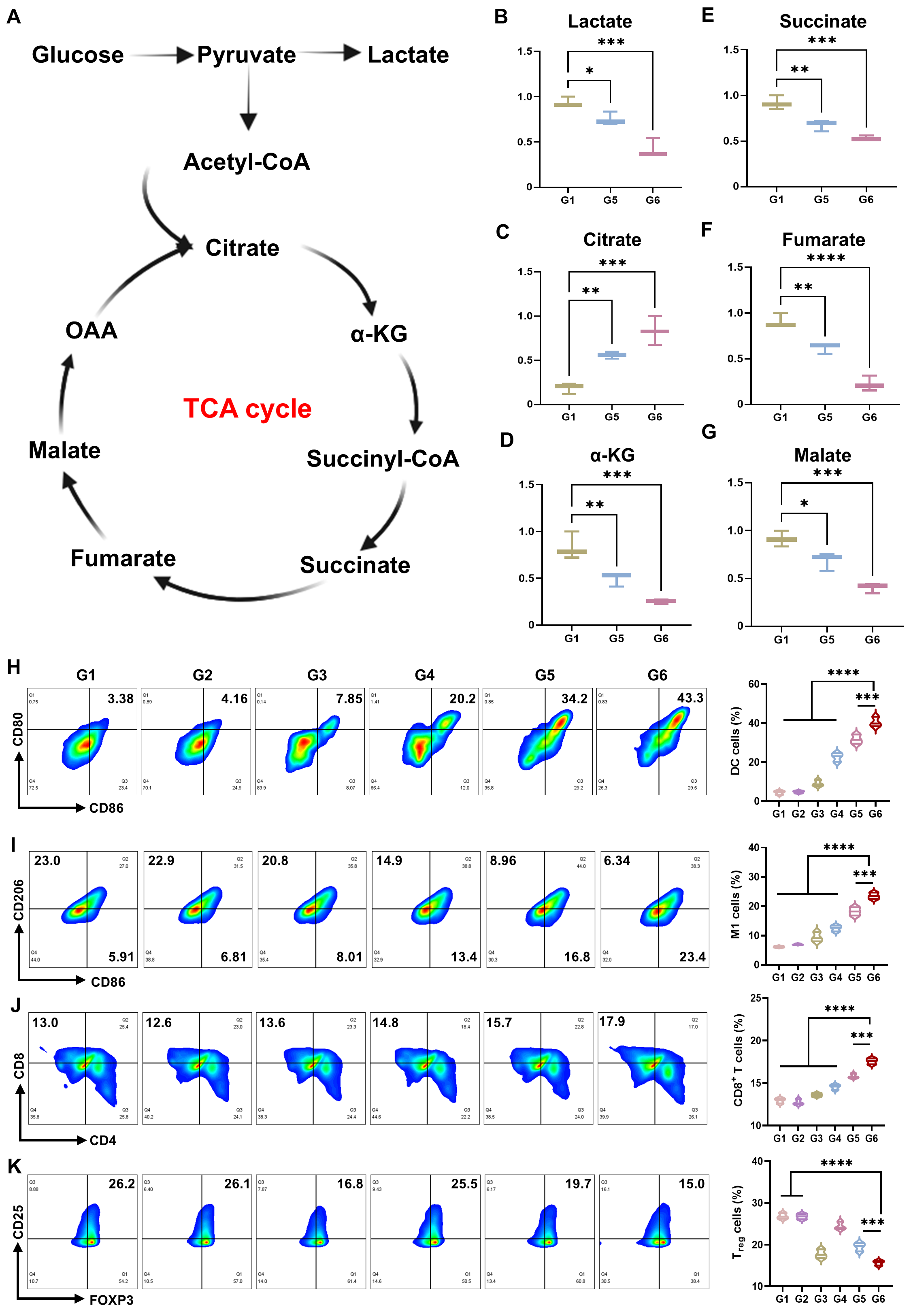
图5:三羧酸循环破坏以及体外免疫激活性能。
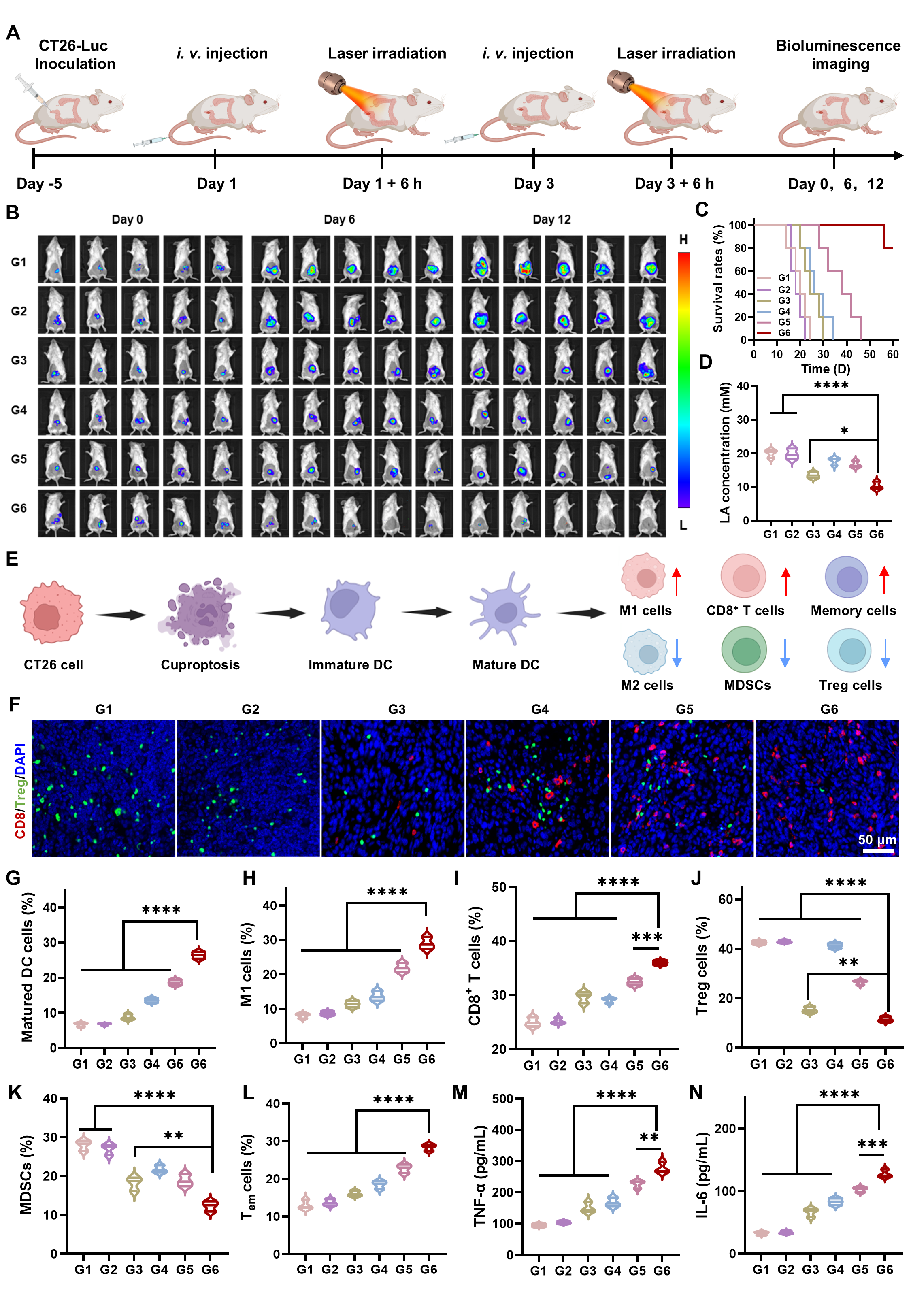
图6:原位结直肠癌抗肿瘤疗效评估。
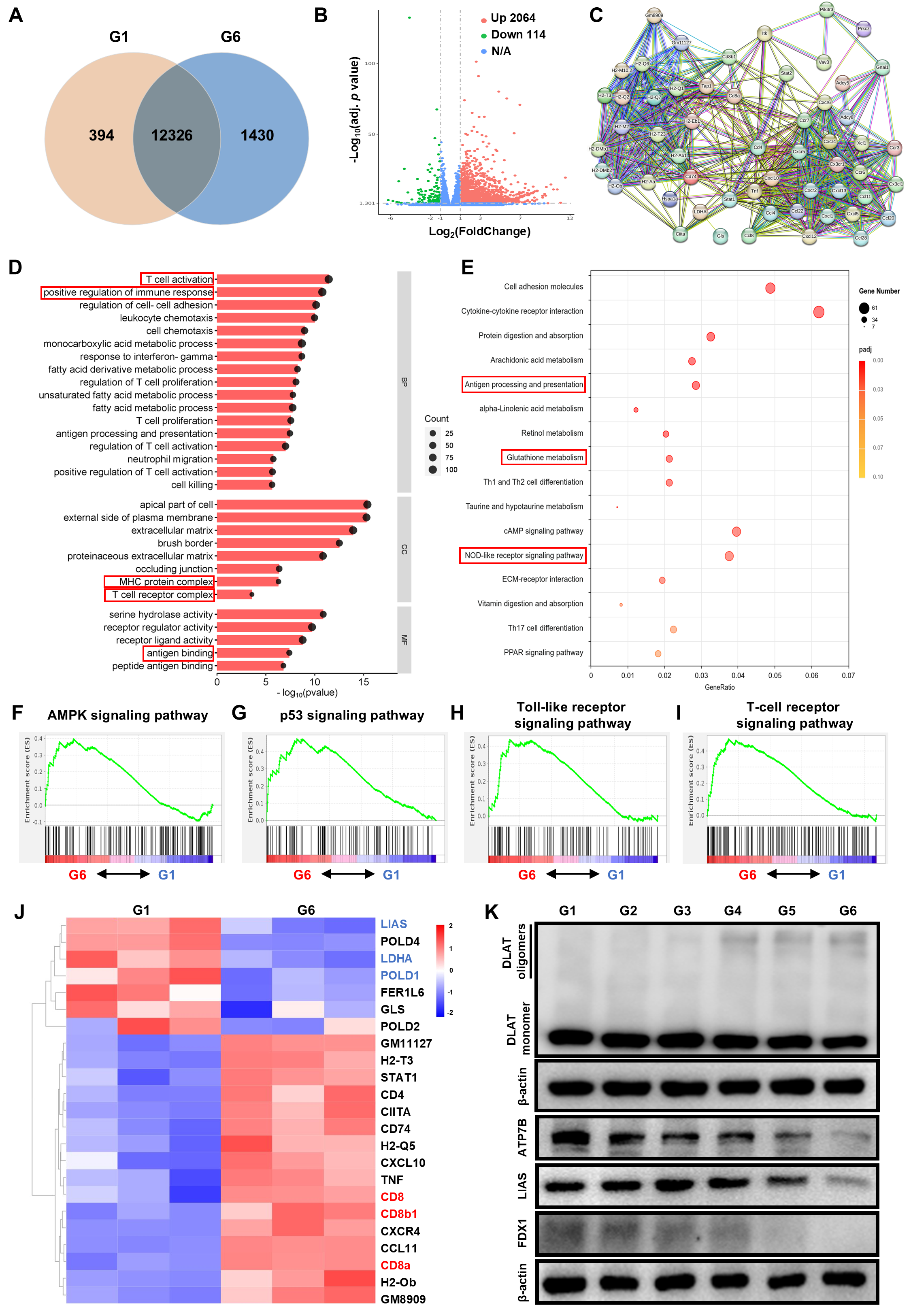
图7:不同治疗处理后肿瘤组织的RNA测序分析。
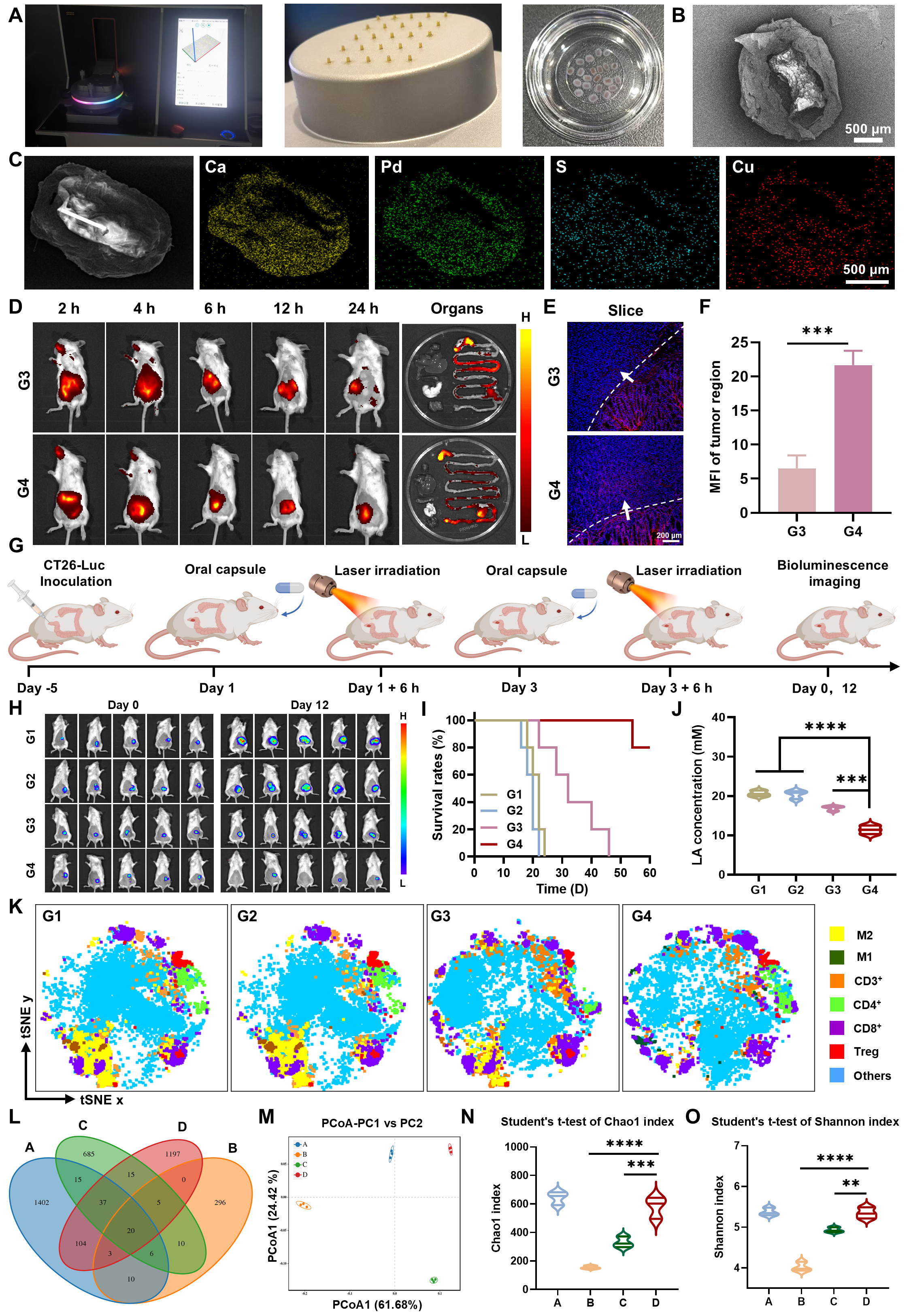
图8:口服纳米机器人胶囊的构建及其在原位结直肠癌模型中的抗肿瘤效果评估。
(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2025.102750