|
|
|
|
|
QB | 前沿研究:Tau蛋白的原子分辨率结构及基于结构抑制剂的最新研究 |
|
|
论文标题:Recent Studies of Atomic-Resolution Structures of Tau Protein and Structure-Based Inhibitors (Tau蛋白的原子分辨率结构及基于结构抑制剂的最新研究)
期刊:Quantitative Biology
作者:Lili Zhu, Zhenyu Qian
发表时间:14 Jan 2022
DOI:10.15302/J-QB-021-0271
微信链接:点击此处阅读微信文章
阿尔茨海默病(Alzheimer’s disease,AD)是一种最常见的痴呆病,其主要病理特征是神经元外β-淀粉样蛋白(β-Amyloid,Aβ)形成的斑块和神经元内tau蛋白形成的神经纤维缠结(neurofibrillary tangles,NFTs)。随着靶向Aβ的抗AD药物在临床实验上的持续失败,科学家们逐渐认识到tau蛋白在AD以及相关神经退行性疾病中的重要作用。
近些年,越来越多的抑制剂被开发出来,它们能够在体内外抑制tau聚集或分解tau纤维。而通过冷冻电镜技术获得了tau在不同疾病中的纤维形态,结合计算机模拟研究 tau 的单体或寡聚体结构、以及单体与纤维末端结合的动力学,为基于结构的抑制剂提供了结构基础和原子层面的作用机制。
近日,上海体育学院运动科学学院钱振宇教授课题组回顾了tau蛋白原子级分辨率的结构及基于结构的抑制剂的最新进展。作者回顾了tau的结构与功能,以及在病理情况下发生淀粉样变性的过程,强调了tau的核心聚集片段、不同疾病中tau纤维结构的多样性及原子级分辨率结构,系统总结了近几年科学家们通过实验研究和计算机模拟开发出的tau蛋白聚集抑制剂及其作用机制,以期为靶向tau开发相关神经退行性疾病药物提供一定线索和启发。相关文章“Recent Studies of Atomic-Resolution Structures of Tau Protein and Structure-Based Inhibitors”发表在Quantitative Biology期刊上(点击文末“阅读原文”下载PDF全文)。

全文概要
这篇综述主要回顾了tau蛋白的结构和功能,总结了tau蛋白的聚集过程(图1),tau蛋白在单体、寡聚和纤维状态下的原子分辨率结构,以及最近通过实验和计算研究揭示的阻止 tau 聚集或分解 tau 聚集物的抑制剂。
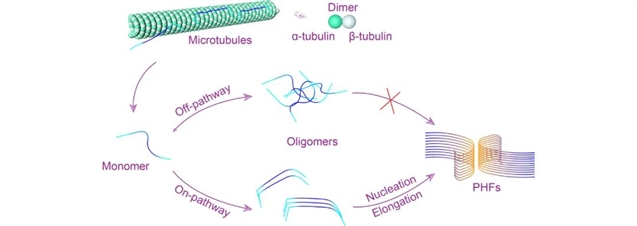
图1 tau蛋白的聚集过程
tau是一种高可溶性的天然无序蛋白质,属于微管相关蛋白家族,广泛存在于中枢神经系统中。tau的重复区域跨越微管蛋白的二聚体内和二聚体间的界面,以α-微管蛋白为中心,沿着微管原丝连接两个β-微管蛋白,促进微管的组装和稳定。在突变或异常磷酸化等异常情况下,tau与微管分离,并通过自组装形成病理性聚集体。与tau自组装有关的神经退行性疾病称为tau蛋白病(tauopathies),包括AD等二十多种神经退行性疾病。tau形成病理性聚集物的关键步骤在于单体错误折叠后,经自组装形成高度有序的、富含β-sheet结构的聚集体。与其他淀粉样蛋白一样,tau的自组装过程经过低聚化、成核和伸长三个阶段。tau低聚物的结构多种多样,而且低聚物的形成也是可逆的。成核过程是tau纤维化过程中相对缓慢但非常关键的一步。一旦核形成,tau便在此核的基础之上不断募集新的tau分子而迅速伸长形成纤维。易于形成β-sheet结构的六肽模体275VQIINK280(PHF6*)和306VQIVYK311(PHF6)是促进tau聚集的核心。通过冷冻电镜获得的tau纤维原子级分辨率结构显示,不同疾病中tau纤维核心的形态不同,表明 tau纤维在不同疾病中的结构多态性。这种多态性说明 tau 作为一种天然无序蛋白质,它的病理性聚集过程非常复杂,这也为相关疾病的早期诊断增加了难度。计算机模拟主要集中于 tau 的单体或寡聚体结构,以及单体与纤维末端结合的动力学。此外计算机模拟也应用于研究抑制剂对这些不同形态的tau在原子层面的作用机制。
作为AD病理性标志物,tau病理的发生和发展并不依赖于Aβ的积累,而是作为一个独立的过程,与Aβ协同作用贯穿AD的整个发展进程,并从根本上推动AD的发展。一旦出现认知缺陷,tau负荷与临床上患者认知损伤的相关性要强于Aβ负荷。随着靶向 Aβ 的药物研发不断失败,科学家们将注意力转向了基于 tau 的药物开发。天然小分子,如多酚类、醌类,短肽以及纳米材料等已经用于抑制 tau 的错误折叠或聚集。这些抑制剂通常带有一个或多个芳香环、羟基或氨基,能够有效地破坏β-sheet结构(图2)。

图2 tau蛋白小分子抑制物结果
大多数抑制剂与 tau最常见的结合位点是易聚集的PHF6或该片段中的某些氨基酸,而抑制剂与tau结合的亲和力主要由氢键和疏水相互作用决定。一些抑制剂甚至可以重塑或分解成熟的原纤维,有机会成为tau相关神经退行性疾病的候选新药。
总而言之,了解原子级结构和当前研究存在的困难可能有助于设计对抗 tau 聚集的药物。我们希望这篇综述能对寻找治疗tau聚集相关疾病的新线索有所启发,并阐明在病症发生之前进行预防或治疗的可能性。
Quantitative Biology期刊介绍
Quantitative Biology (QB)期刊是由清华大学、北京大学、高教出版社联合创办的全英文学术期刊。QB主要刊登生物信息学、计算生物学、系统生物学、理论生物学和合成生物学的最新研究成果和前沿进展,并为生命科学与计算机、数学、物理等交叉研究领域打造一个学术水平高、可读性强、具有全球影响力的交叉学科期刊品牌。
QB期刊目前已被ESCI, Scopus, CSCD等国内外重要数据库收录。

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中13种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。