CD8 T细胞是免疫系统中的细胞毒性淋巴细胞,能够通过释放细胞毒素并诱导靶细胞死亡,有效清除被感染或发生异常的细胞。作为免疫治疗的前沿手段,CD8 T细胞疗法已取得突破性进展。然而,肿瘤微环境常通过抑制性信号传导和免疫逃逸机制限制CD8 T细胞的功能,严重阻碍其治疗效果,成为当前免疫治疗面临的重大挑战。
近日,国家纳米科学中心王海研究员团队发现,肿瘤细胞内线粒体的含量与其对CD8 T细胞杀伤的敏感性相关。线粒体含量低的肿瘤细胞更容易被CD8 T细胞杀伤,而线粒体含量高的则更容易存活。基于这一现象,研究团队进而开发出一种纳米诱导剂,可选择性降解肿瘤细胞中的线粒体,从而增强CD8 T细胞的特异性杀伤能力。这一创新策略显著提升了多种免疫治疗手段的疗效。相关研究成果以“Nanoinducers-Mediated Mitochondria-Selective Degradation Enhance T Cell Immunotherapy Against Multiple Cancers”为题,发表在《自然-纳米技术》(Nature Nanotechnology)期刊上。
研究团队开发的纳米诱导剂(mitoNIDs)可以通过邻近诱导效应促进线粒体与自噬相关蛋白LC3的结合,从而导致肿瘤细胞内线粒体经自噬途径选择性降解。研究发现,mitoNIDs诱导的肿瘤细胞内线粒体含量的降低,一方面上调了I类主要组织相容性复合体(MHC-I)的表达,促进抗原呈递效率;另一方面抑制抗凋亡蛋白BCL-XL,削弱肿瘤细胞的抗凋亡能力,从而显著增强了其对CD8 T细胞介导的免疫杀伤的敏感性。此外,mitoNIDs介导的线粒体降解还可改变肿瘤细胞的代谢状态,促进溶血磷脂酰肌醇(LPI)的释放,以激活CD8 T细胞的G蛋白偶联受体55(GPR55)-ErK信号通路,增强CD8 T细胞的活化与增殖。体内实验验证了mitoNIDs通过调控线粒体降解,显著增强了过继性T细胞疗法、CAR-T细胞治疗及个性化mRNA疫苗等多种免疫疗法的抗肿瘤效果。综上所述,本研究设计的这种可调控肿瘤细胞内线粒体代谢过程的纳米诱导剂,能够通过多重机制增强CD8 T细胞的细胞毒性反应,为癌症免疫治疗提供了全新的思路与前景。
国家纳米科学中心博士后潘雪婷,硕士毕业生王志航和联合培养的博士毕业生谭米肖为本文的共同第一作者,王海研究员为本文的唯一通讯作者。该研究得到了国家自然科学基金等项目的支持。
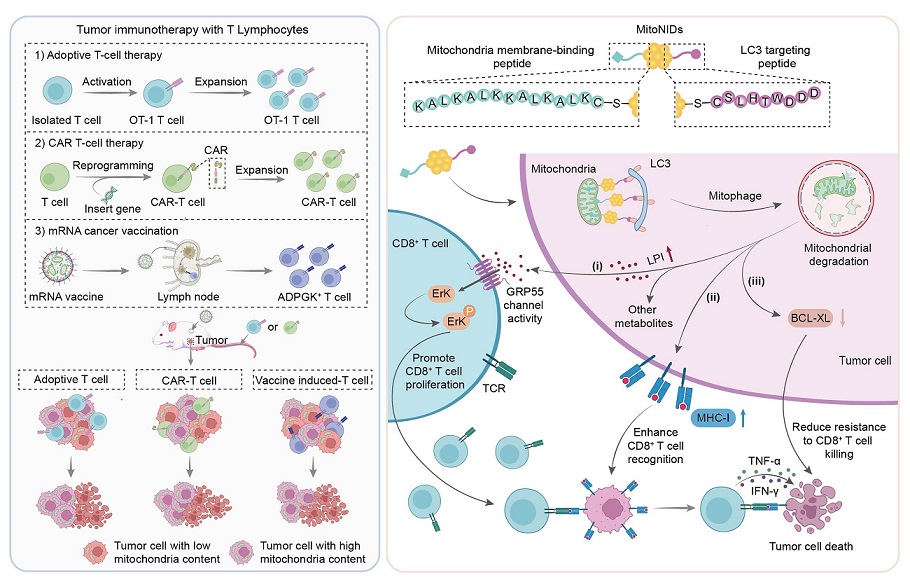
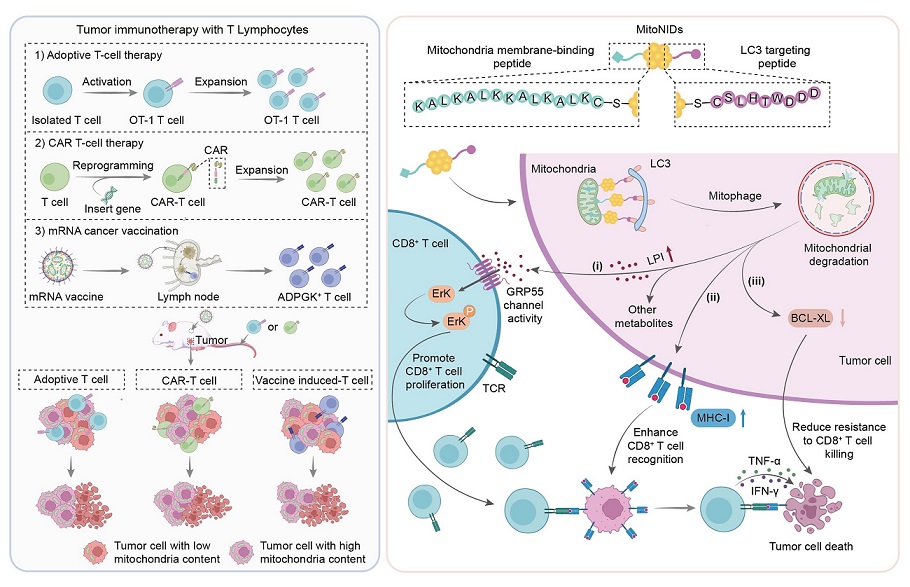 图.纳米诱导剂介导的线粒体选择性降解增强CD8+ T细胞免疫疗法的示意图
图.纳米诱导剂介导的线粒体选择性降解增强CD8+ T细胞免疫疗法的示意图
?
原文链接:https://www.nature.com/articles/s41565-025-01909-0
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。