中国科学院南海海洋研究所研究员王晓雪团队在国家自然科学基金、科技基础资源调查专项等项目的资助下,研究发现非经典内在终止子促进毒素-抗毒素系统(Toxin-Antitoxin,TA)介导的接合耐药质粒传播。2月27日,相关成果在线发表于《核酸研究》(Nucleic Acids Research)。
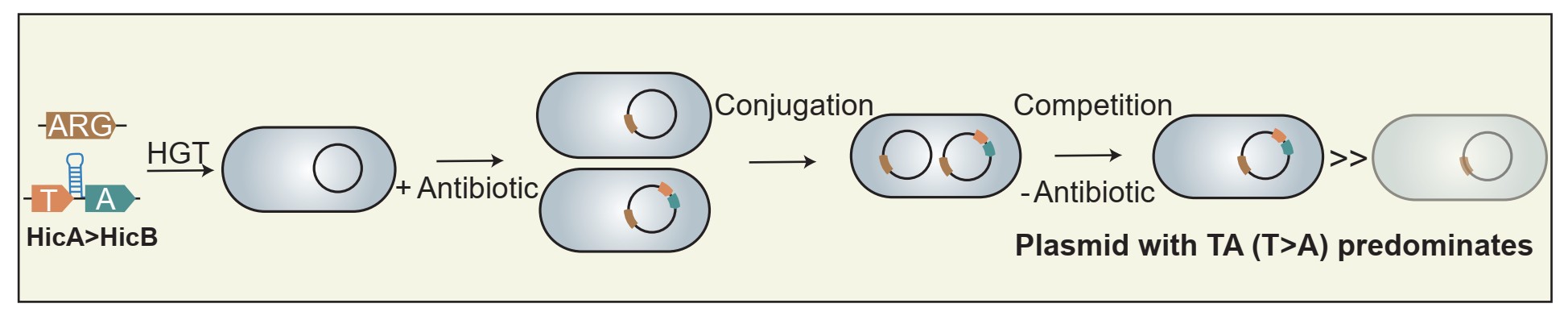 非经典内在终止子促进毒素-抗毒素系统介导的接合耐药质粒传播。研究团队供图
非经典内在终止子促进毒素-抗毒素系统介导的接合耐药质粒传播。研究团队供图
?
尽管多种策略被指定来限制抗生素滥用,但通过接合型质粒传播的抗生素耐药基因的传播仍然是一场全球公共卫生领域的重大挑战。携带粘菌素耐药基因mcr-1的IncI2类型质粒在全球范围内广泛传播,即使在粘菌素被禁止作为饲料添加剂后仍在临床中持续存在。这些质粒通常携带多对TA系统,但TA系统的功能差异及其在抗生素限用后持续传播的机制仍不明确。
研究团队对携带mcr-1耐药基因的IncI2类型质粒上两大类TA系统进行,研究发现HicAB(而非StbDE)系统是增强质粒间水平竞争的关键成瘾模块,阐明了HicAB通过重编程TA系统的转录控制质粒竞争力的新策略。与传统的II型TA系统不同,IncI2质粒上的HicAB系统利用毒素基因位于抗毒素基因上游的布局,引入了非经典内在转录终止子,提高毒素蛋白与抗毒素蛋白的比例发挥“成瘾效应”。这种新编程的TA转录模式显著增强了无抗生素选择压力下的质粒竞争力和质粒存续能力。
该研究阐明了TA操纵子调控网络的动态重构机制对质粒在微生物群落中获得定殖优势的影响,为靶向控制耐药基因传播提供了关键理论依据。研究聚焦IncI2型接合质粒这类重要耐药基因载体,其作为多粘菌素和β-内酰胺类耐药基因快速传播的核心媒介,在抗生素滥用背景下于环境中显著富集。
值得注意的是,这类质粒展现出独特的生态适应性优势:其宿主适应性代价较低,即便在抗生素使用受限的情况下仍能稳定存续,最终演化为耐药基因和毒力因子传播的重要载体。该研究表明通过靶向TA系统开发特异性抑制剂可有效消解这类"基因传播工具"的生态适应性优势。
该研究发现为临床及环境领域遏制耐药基因传播提供了重要的干预靶点,对完善耐药性传播防控策略具有显著科学价值。
相关论文信息:https://doi.org/10.1093/nar/gkaf125
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。