中国科学院上海药物研究所研究员罗成、周兵、陈奕和华东师范大学研究员陈示洁合作,提出“强支点占据-杠杆干扰”(FOLP)的蛋白-蛋白相互作用(PPI)先导化合物设计策略,为PPI领域研究提供新的概念和方法,将有助于未来其他PPI调控剂的开发。相关研究8月19日发表于《德国应用化学》,并被推荐为“Hot Paper”。
PPI参与信号转导、结构组装以及细胞周期调控等过程,其失衡或异常可直接引发癌症、神经退行性病变及自身免疫病等一系列疾病。与传统药物靶标相比,PPI界面具有开放性、动态性、广泛性等特点。但受限于界面平坦、亲和力低等问题,难以快速获得高活性、高选择性的PPI先导化合物。
针对以上问题,研究团队提出FOLP新策略,即将已知高亲和力片段作为“支点”稳固锚定正构口袋,再利用分子模拟技术设计“杠杆”伸入邻近的互作界面处潜在变构口袋,扰动互作界面,快速获得高活性PPI抑制剂,从而实现撬动PPI、最终破坏PPI的目的。
在此基础上,研究团队以CDK2-Cyclin A2为模型进行了概念验证。研究团队首先确定了CDK2的A-loop位置存在潜在的变构口袋,进而以泛CDK抑制剂AT7519为“支点”往A-loop口袋延伸杠杆,快速合成并筛选出纳摩尔级PPI抑制剂LC-K2CAin-3。进一步地,研究团队证实了LC-K2CAin-3可稳定A-loop,将CDK2锁定在不利于与Cyclin A2结合的构象,从而瓦解其蛋白-蛋白相互作用。LC-K2CAin-3在CDK2高表达的黑色素瘤细胞中通过选择性破坏CDK2与Cyclin A2相互作用,进而诱导G2/M期阻滞与细胞凋亡,表明其具备抗肿瘤的潜力。(来源:中国科学报 江庆龄)
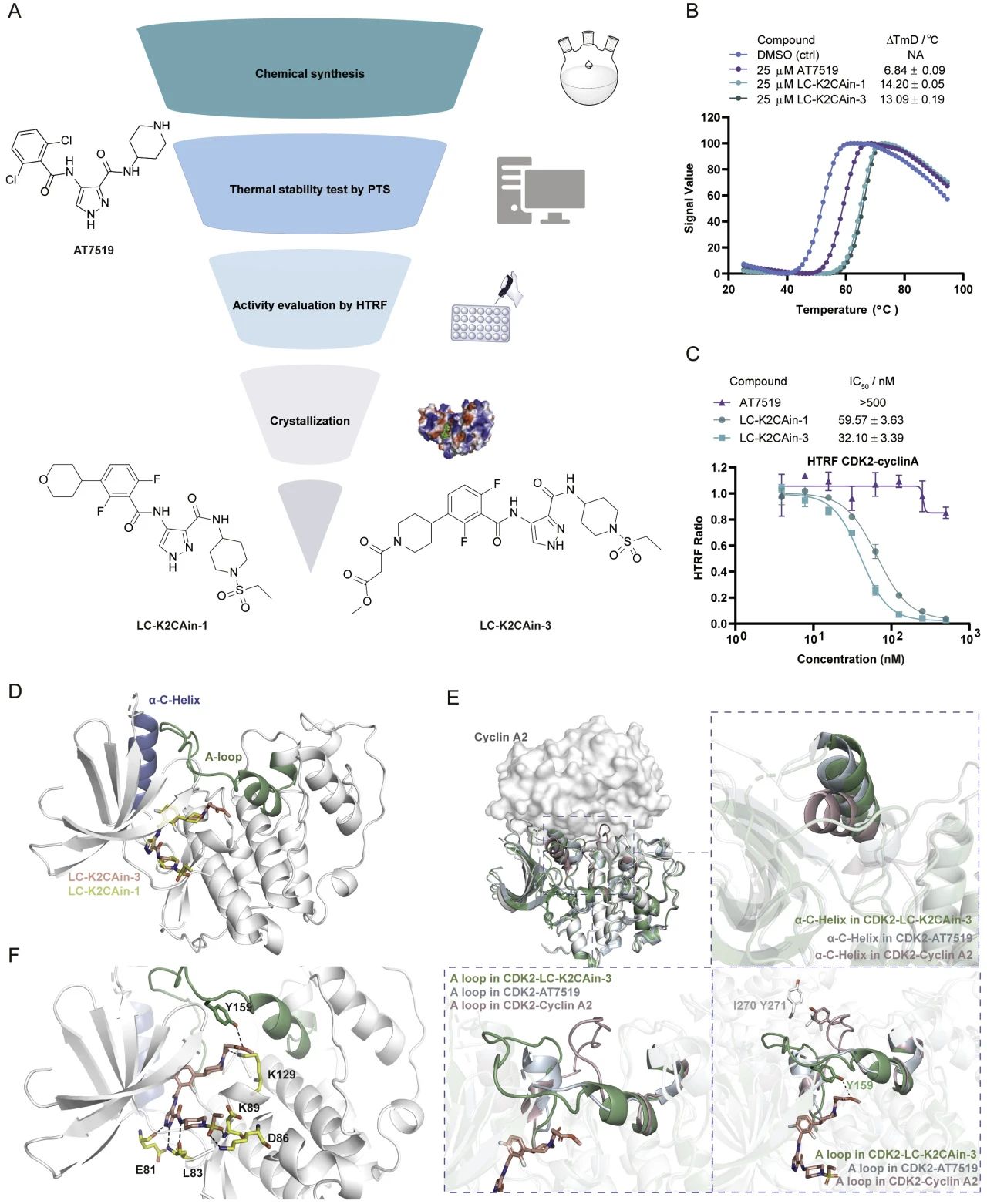 CDK2-Cyclin A2互作抑制剂LC-K2CAin-3的活性表征与结构基础解析。图片由研究团队提供
CDK2-Cyclin A2互作抑制剂LC-K2CAin-3的活性表征与结构基础解析。图片由研究团队提供
?
相关论文信息:https://doi.org/10.1002/ange.202513542