2025年6月24日,美国伊利诺伊大学香槟分校(University of Illinois Urbana-Champaign)赵惠民教授团队在Nature Catalysis期刊在线发表了题为“Photoenzymatic stereoablative enantioconvergence of γ-chiral oximes via hydrogen atom transfer”的研究成果。
该研究报道了一种基于光酶催化氢原子转移的对映汇聚策略,实现官能团远端的γ-手性碳氢键的立体选择性重构。赵惠民教授为通讯作者,张郑一和李茂霖为共同第一作者。
由外消旋体合成对映纯的手性分子在药物、材料和天然产物合成中有广泛的应用前景。尽管传统的有机合成方法在官能团近端手性构建方面已取得显著进展,但对于远离官能团的碳氢键实现高效、对映选择性的构筑,仍是当前化学方法的难题。主要限制因素是官能团远端碳氢键的活性较低、空间位阻难以控制,以及存在复杂的副反应。
相比之下,生物催化具备独特优势。酶以其高度结构化的活性位点,能够在温和条件下实现对底物的精确识别与空间调控,尤其在立体选择性转化中表现出色。近年来,借助定向进化与人工设计,许多天然的非光酶被成功“改造”以参与光诱导自由基反应,拓展了酶在非天然反应中的应用边界。
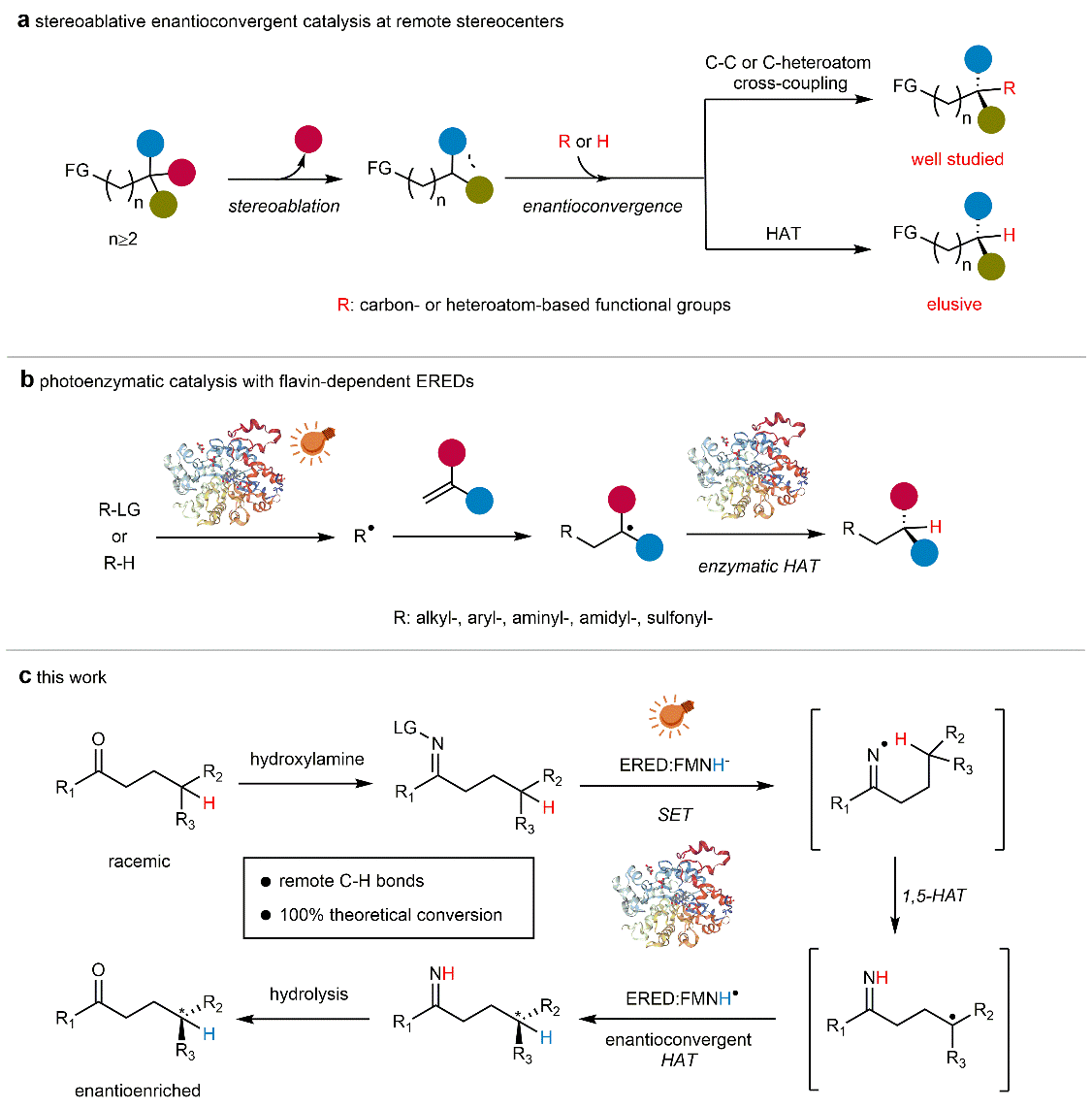
图1:光酶催化对映汇聚反应设计。
在该项研究中,赵惠民团队设计了一种结合光诱导单电子转移与氢原子转移(HAT)的催化体系,利用黄素依赖型烯还原酶(ERED)在蓝光照射下形成亚胺基自由基,诱发γ-位点的1,5-HAT实现手性信息的“消除”,随后通过酶活性位点控制的对映选择性HAT完成产物的手性重建,最终通过水解生成γ-手性酮产物。该策略突破了传统酶催化的空间限制,在实现反应远距立体控制的同时,避免了半量原料损耗,理论上可实现100%的对映体转化率。
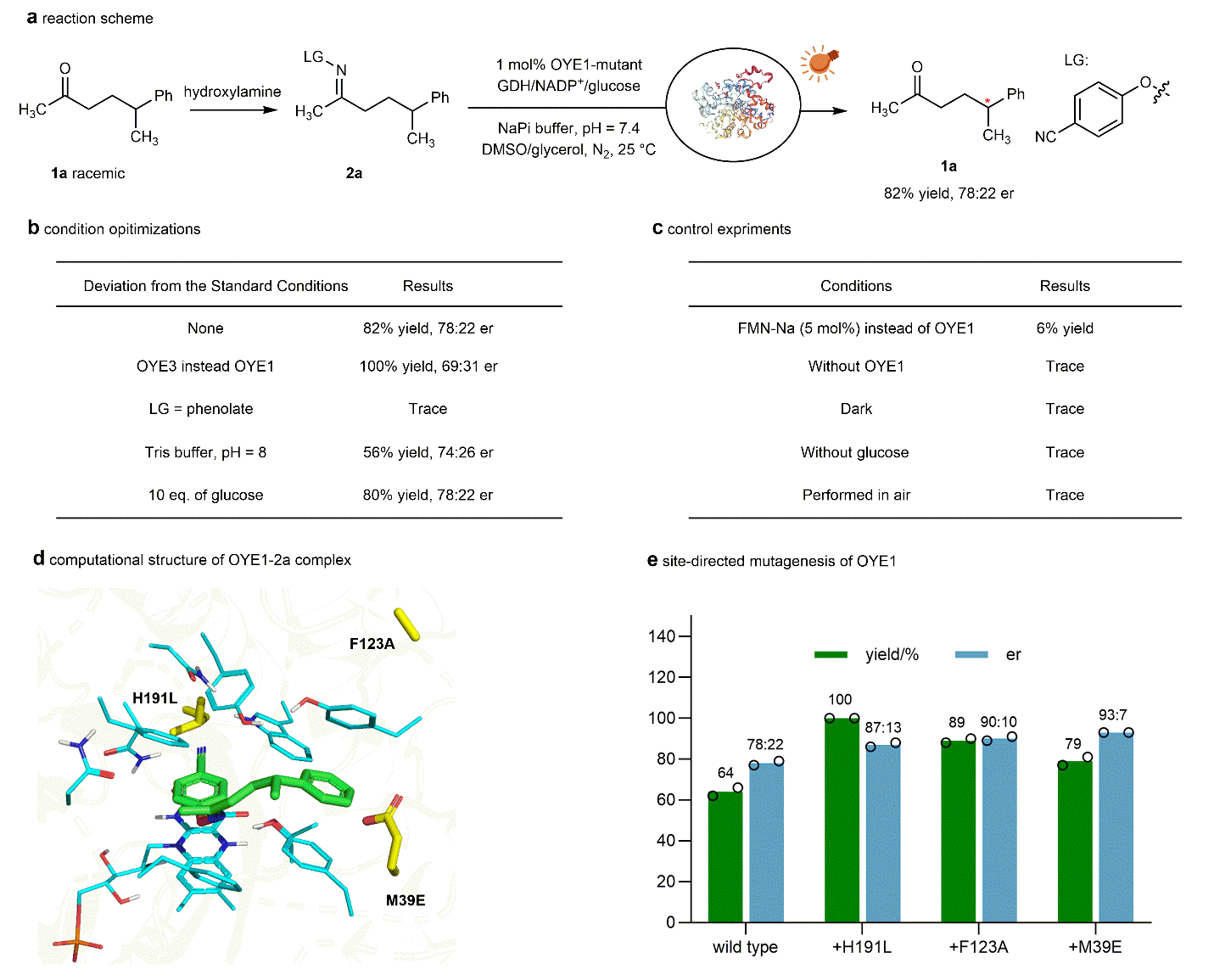
图2:反应条件优化和定向进化。
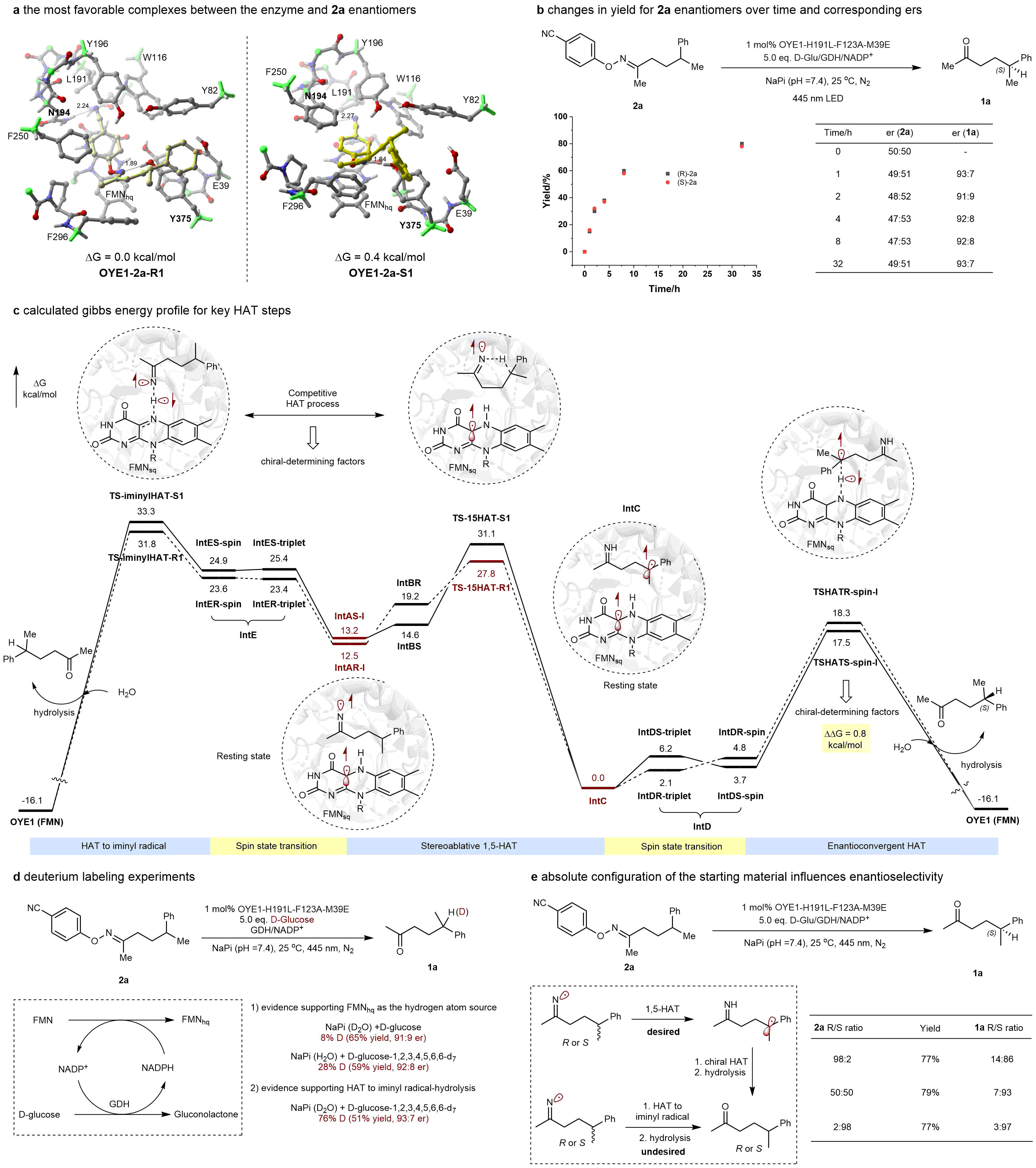
图3:反应机制研究。
从机制上看,作者通过一系列实验和计算发现:R/S底物在该体系中具有相似的反应性;γ-手性中心的氢原子主要来源于还原态黄素(FMNH-);存在亚胺基自由基直接从半醌态黄素(FMNsq)获得氢的副反应,和目标1,5-HAT构成竞争。
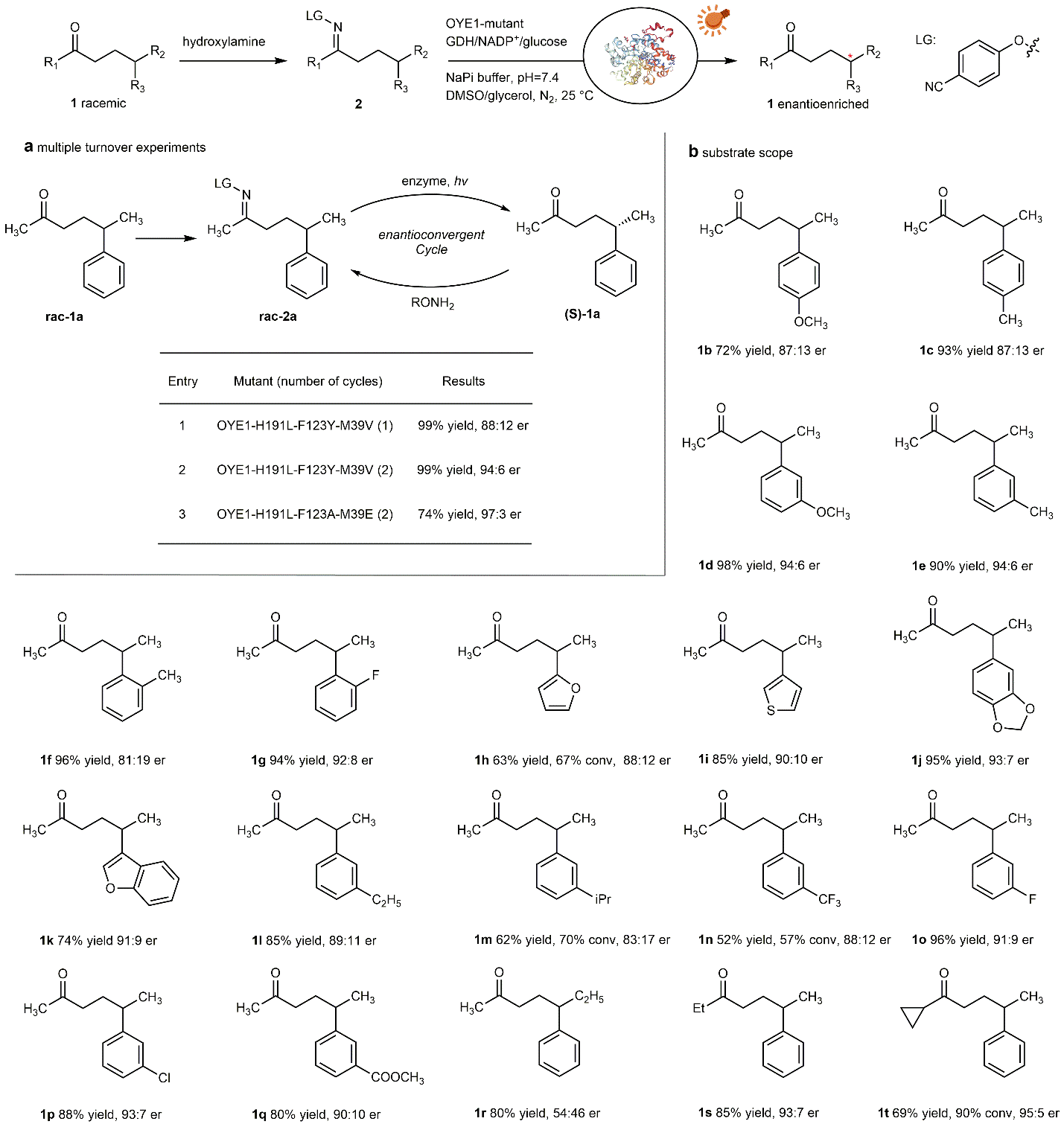
图4:底物范围。
在此基础上,研究团队进一步引入多轮对映汇聚催化循环,有效富集优势构型产物,最高可实现最高97:3 e.r.与99%的产率。该方法适用于一系列含芳香基或杂环结构的γ-手性底物,展现出一定的底物适应性。
该策略有望应用于药物合成、材料功能化及分子骨架改造等前沿领域,为发展绿色、精准的生物合成技术提供新的思路。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41929-025-01347-0