2025年5月8日,北京理工大学高昂团队、中国科学院生物物理所高璞团队合作,在《细胞》(Cell)杂志发表了题为“Cyclic dinucleotide-induced filamentous assembly of phospholipases governs broad CBASS immunity”的研究论文。
该研究揭示了CBASS系统磷脂酶类效应蛋白在响应环状寡核苷酸分子后,自组装形成超分子纤维结构,进而降解细菌内膜完成细胞杀伤的分子机制。这一发现不仅拓展了细菌免疫应答的多样性,也为开发新型抗病毒策略和可控细胞裂解工具提供了理论依据。

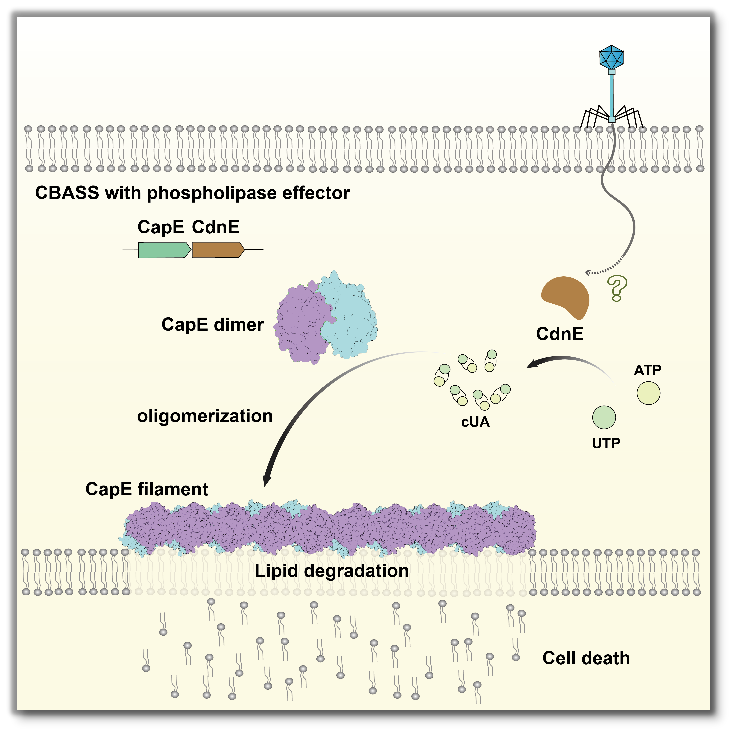
亿万年的时间里,噬菌体与细菌之间不断进行着攻击-防御-反击的战斗。为了阻止噬菌体入侵,细菌进化出一系列复杂而精巧的抗噬菌体防御系统,又被称为“原核生物的免疫系统”。其中,基于环状寡核苷酸的抗噬菌体信号传导系统(CBASS,cyclic-oligonucleotide-based anti-phage signaling systems)备受关注。该系统在响应噬菌体感染后被激活,通过合成环状寡核苷酸第二信使分子,迅速放大信号,进而激活下游效应蛋白,引发细胞杀伤作用,导致细菌在噬菌体复制完成前死亡,阻止了噬菌体的复制和扩散。
CBASS系统是一个庞大且高度多样化的防御系统,存在于超过10%的细菌与古细菌中。值得注意的是,该系统与高等生物cGAS-STING免疫通路具有明确的进化同源性。然而,CBASS系统中最早被发现、分布最广的磷脂酶类效应蛋白如何被激活并发挥细胞杀伤功能的分子机制尚不清楚,是领域内长期悬而未决的问题。
研究团队发现,在未被激活的静息状态下,来源于大肠杆菌的CBASS磷脂酶类效应蛋白CapE以二聚体形式存在,且底物通道处于封闭状态。该效应蛋白与环状寡核苷酸信号分子cUA的亲和力极高。进一步实验发现,向CapE溶液中加入cUA后,蛋白从溶液状态转变为凝胶态。冷冻电镜结构分析表明,cUA的结合触发CapE发生关键构象变化,CapE二聚体以“头尾相接”的方式线性堆叠,自组装形成纤维状超分子复合物。纤维状复合物的形成使得通往酶活中心的底物通道开放,原本隐藏的催化位点暴露,促使效应蛋白从静息态转变为活化状态。活化后的CapE磷脂酶类效应蛋白能够高效裂解细胞膜,最终导致细胞裂解和死亡。
研究者通过对上述实验结果的分析,确定了CapE在识别cUA、分子自组装及催化活化过程中的关键位点。随后,结合定点突变及噬菌体感染实验,系统地验证了这些关键位点对CapE抗噬菌体功能的重要性。为进一步模拟CapE被cUA激活后裂解细胞膜的过程,研究者采用脂质体模拟细胞膜结构,并加入CapE与cUA进行电镜观察,结果表明CapE在响应cUA后能够通过自组装介导膜裂解。此外,研究团队还利用冷冻电子断层扫描(cryo-ET)和超分辨荧光成像,观察到噬菌体感染过程中,CapE在细菌细胞内聚集并形成纤维状结构的现象。
值得注意的是,研究者发现来源于霍乱弧菌的类似效应蛋白CapV(CapE同源蛋白)在结合第二信使分子3′3′-cGAMP后,同样可形成纤维状结构,提示通过超分子组装执行细胞杀伤功能可能是CBASS磷脂酶类效应蛋白的保守机制。更有趣的是,磷脂酶类效应蛋白在结合环状寡核苷酸后形成的超分子纤维结构,与真核细胞中cGAS-STING通路激活后的多聚化组装现象非常相似。这就像是数亿年前的一次基因“分家”,细菌选择直接裂解细胞阻断病毒传播,而人类细胞则演化出更精细的免疫应答——但它们的核心逻辑惊人一致。
综上所述,该研究系统性地揭示了CBASS系统磷脂酶类效应蛋白响应环状寡核苷酸信号分子后的自组装及细胞杀伤机制,为深刻理解细菌抗病毒系统的作用模式提供了关键信息,并为基于该系统的分子生物学工具的开发提供了重要基础。
北京理工大学博士研究生王靖格为本文的第一作者;北京理工大学高昂教授和生物物理所高璞研究员为共同通讯作者。生物物理所李栋研究员团队和孙飞/朱赟研究员团队为该研究提供了重要帮助。(来源:科学网)
相关论文信息:DOI: 10.1016/j.cell.2025.04.022