|
|
|
|
|
FMD | 精彩荐读:lncRNA ZNF593-AS通过上调Mfn2表达抑制心肌肥厚和心肌重构 |
|
|
论文标题:lncRNA ZNF593-AS inhibits cardiac hypertrophy and myocardial remodeling by upregulating Mfn2 expression
期刊: Frontiers of Medicine
作者:Xiang Nie, Jiahui Fan, Yanwen Wang, Rong Xie, Chen Chen, Huaping Li, Dao Wen Wang
发表时间:15 Jun 2024
DOI: 10.1007/s11684-023-1036-4
微信链接:点击此处阅读微信文章
导 读
华中科技大学同济医学院汪道文、李华萍等在Frontiers of Medicine发表研究论文《lncRNA ZNF593-AS通过上调Mfn2表达抑制心肌肥厚和心肌重构》(lncRNA ZNF593-AS inhibits cardiac hypertrophy and myocardial remodeling by upregulating Mfn2 expression)。本研究发现长链非编码RNA ZNF593-AS在心脏肥大中表达下调,通过靶向上调线粒体融合蛋白2(Mfn2)的表达,改善线粒体氧化磷酸化功能,从而抑制了压力过载诱导的病理性心脏肥大和心肌重塑。
心脏肥大是心脏在应对血流动力学过载、缺血或心肌结构蛋白基因缺陷等刺激时产生的适应性代偿变化,然而持续的压力过载会逐渐引发病理性肥大,表现为心肌细胞增大和心脏功能障碍,若不及时干预,最终可能进展为心力衰竭。在这一病理过程中,线粒体功能异常被认为是关键环节之一,而线粒体融合蛋白2(Mfn2)作为调节线粒体融合与功能的重要分子,其表达异常与心脏肥大密切相关。既往研究表明,长链非编码RNA(lncRNA)在心血管疾病中通过多种分子机制调控生理和病理过程,但lncRNA在心脏肥大中对Mfn2表达的调控作用尚不明确。同时,已有研究提示lncRNA ZNF593-AS在心力衰竭失代偿期显著减少,并有助于改善心脏钙处理和收缩功能,而在心脏肥大这一心力衰竭的早期阶段,ZNF593-AS表达受抑制且线粒体功能受损,但其具体作用机制仍有待深入探索。
华中科技大学同济医学院汪道文、李华萍等通过体内外实验探讨了lncRNA ZNF593-AS是否通过调控Mfn2表达及线粒体功能来影响心脏肥大进程,揭示了其在心脏肥大发病机制中的作用,为病理性心肌重塑的治疗提供了新的潜在靶点。
为明确ZNF593-AS在心脏肥大中的作用,研究团队首先构建了左心室肥大的小鼠模型,并在心肌细胞中使用肥大激动剂苯肾上腺素(PE)处理。结果发现,ZNF593-AS的表达在两种模型中均显著降低(图1)。进一步的体内实验中,通过CRISPR/Cas9系统构建了ZNF593-AS基因敲除小鼠,发现敲除ZNF593-AS会加剧压力过载(经主动脉缩窄术,TAC)诱导的心脏肥大,表现为心脏重量/体重比增加、心肌细胞横截面积增大,左心室壁厚度显著增厚(图2);而心肌细胞特异性过表达ZNF593-AS的转基因小鼠(ZNF593-AS MHC-Tg)则展现出TAC诱导的心脏肥大减轻的表型,上述指标均得到改善(图3)。体外实验中,在人心肌细胞(AC16细胞)和小鼠心肌细胞(HL-1细胞)中分别过表达或敲低ZNF593-AS,结果显示过表达ZNF593-AS可缓解苯肾上腺素诱导的心肌细胞肥大,而敲低则加剧了肥大表型,且这种抗肥大作用在人与小鼠之间具有保守性(图4)。
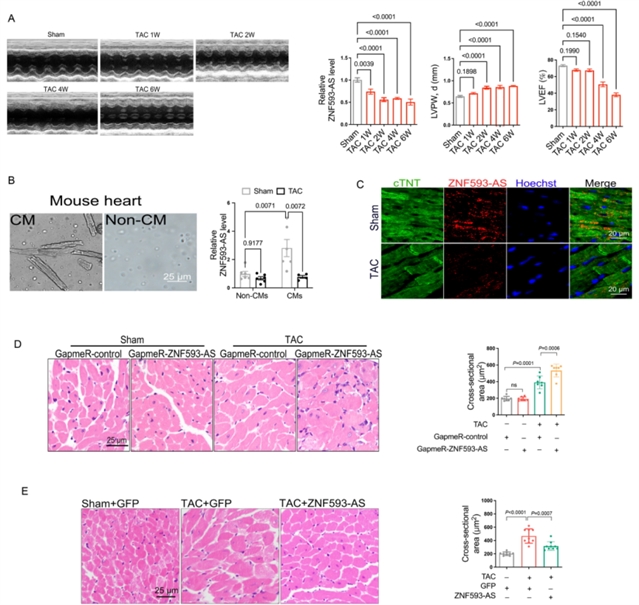
图1 ZNF593-AS在心脏肥大中表达下调
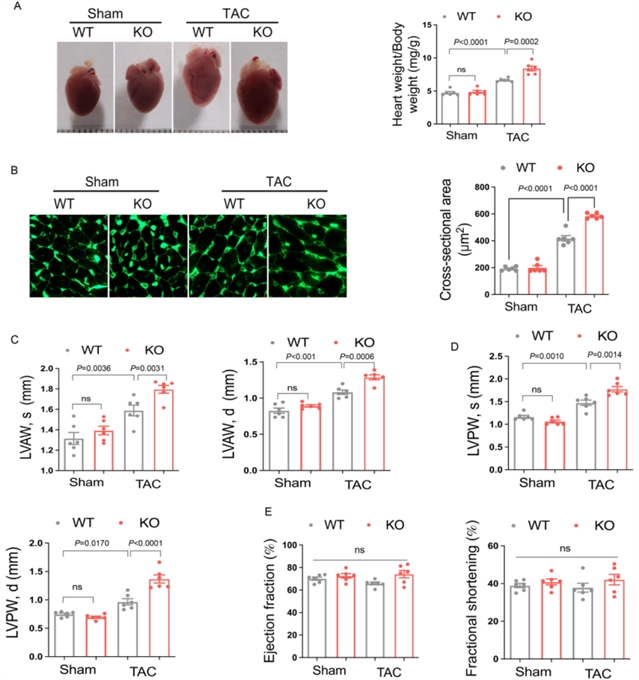
图2 ZNF593-AS敲除加剧TAC诱导的心脏肥大
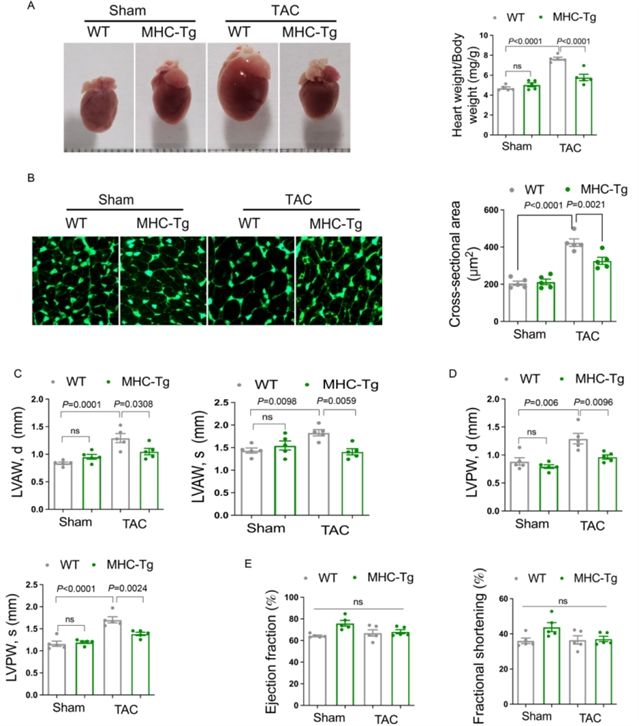
图3 ZNF593-AS过表达可减轻TAC诱导的心脏肥大
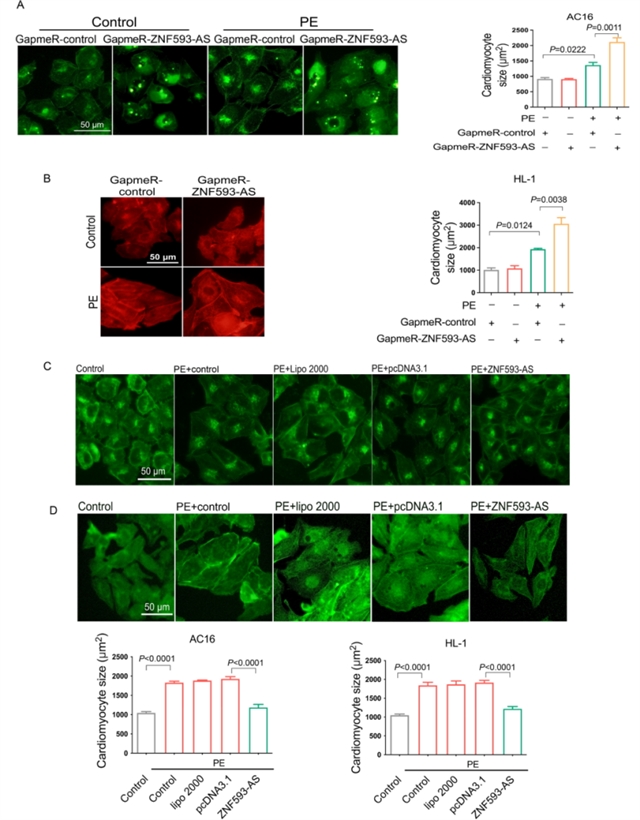
图4 ZNF593-AS的抗肥大作用在人与小鼠之间具有保守性
为探究ZNF593-AS发挥作用的分子机制,研究团队对ZNF593-AS敲除和转基因小鼠的心脏组织进行了RNA测序和基因集富集分析,发现氧化磷酸化通路在两组小鼠中均发生显著变化(图5)。进一步检测氧化磷酸化相关蛋白发现,ZNF593-AS过表达可缓解TAC诱导的SDHB、UQCRC2和ATP5A等蛋白表达降低,并逆转心脏ATP水平的下降;而敲除ZNF593-AS则加剧了这些变化,同时体外敲低ZNF593-AS还会降低细胞的氧化磷酸化水平并增加活性氧的生成。通过对差异表达基因的筛选,研究团队确定Mfn2是ZNF593-AS的直接靶基因。实验证实,ZNF593-AS敲除会显著降低Mfn2表达,而过表达则增加其表达,且ZNF593-AS通过与RNA结合蛋白HNRNPC相互作用,直接结合Mfn2启动子区域以促进其转录(图6)。此外,ZNF593-AS还通过调控Mfn2表达影响线粒体自噬,敲除ZNF593-AS会加剧TAC诱导的自噬异常,而过表达则可逆转这一现象。
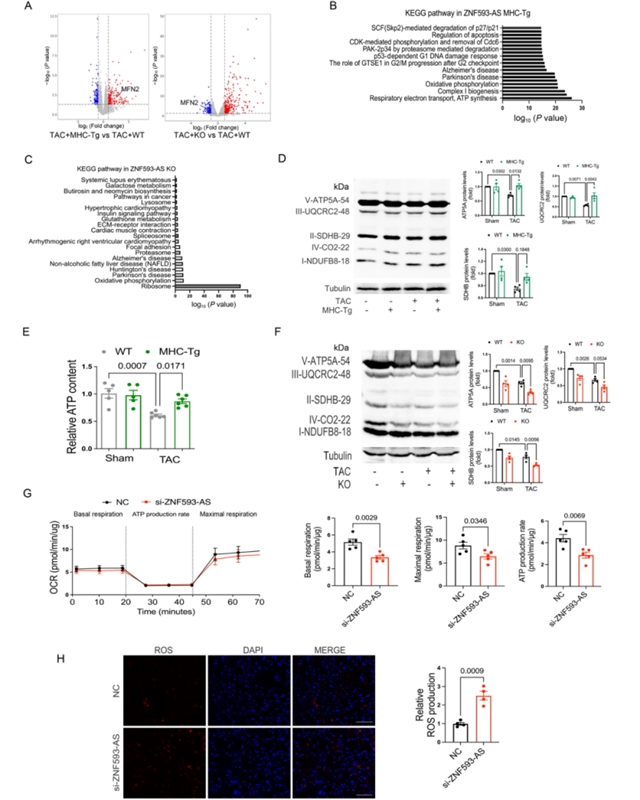
图5 ZNF593-AS调控心脏肥大中的氧化磷酸化
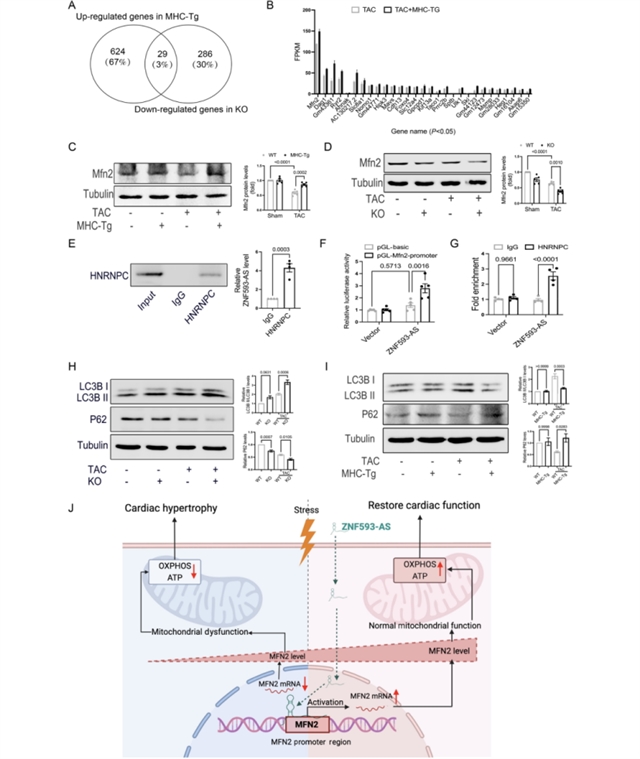
图6 ZNF593-AS通过靶向Mfn2表达调控线粒体功能
本研究揭示了ZNF593-AS在压力过载诱导的病理性心脏肥大中的重要作用,阐明了其通过上调Mfn2表达、改善线粒体氧化磷酸化功能和调控线粒体自噬来抑制心脏肥大的分子机制。这一发现不仅为理解心脏肥大的病理生理过程提供了新的视角,还发现了ZNF593-AS作为潜在治疗靶点的可能性,为开发针对病理性心肌重塑的新型治疗策略奠定了理论基础。
原文信息
标题
lncRNA ZNF593-AS inhibits cardiac hypertrophy and myocardial remodeling by upregulating Mfn2 expression
作者
Xiang Nie1,2, Jiahui Fan1,2, Yanwen Wang1,2, Rong Xie1,2, Chen Chen1,2, Huaping Li1,2, Dao Wen Wang1,2
机构
1. Division of Cardiology, Department of Internal Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
2. Hubei Key Laboratory of Genetics and Molecular Mechanisms of Cardiological Disorders, Wuhan 430030, China
通讯作者
Huaping Li, Dao Wen Wang
引用这篇文章
Xiang Nie, Jiahui Fan, Yanwen Wang, Rong Xie, Chen Chen, Huaping Li, Dao Wen Wang. lncRNA ZNF593-AS inhibits cardiac hypertrophy and myocardial remodeling by upregulating Mfn2 expression. Front. Med., 2024, 18(3): 484-498
https://doi.org/10.1007/s11684-023-1036-4
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1036-4
https://link.springer.com/article/10.1007/s11684-023-1036-4
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。