|
|
|
|
|
基于适配体的可编程荧光RNA开关用于快速鉴定位点突变 |
|
|
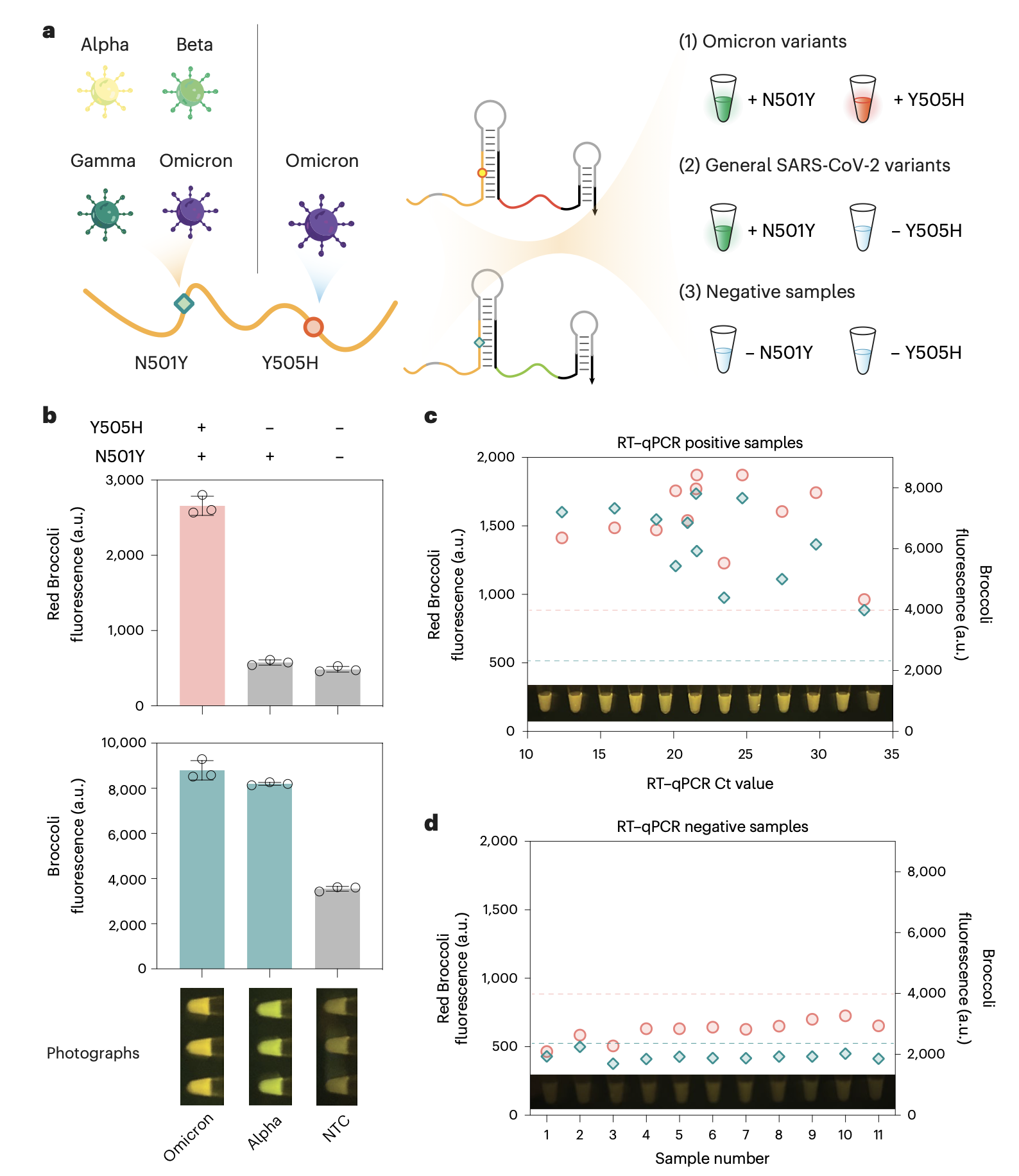
单核苷酸多态性检测对遗传疾病诊断、病原体耐药性评估和感染传播防控至关重要。然而,现有检测方法在实现序列特异性识别、RNA结构稳定性和功能效能的平衡方面面临挑战。为解决这一难题,来自美国波士顿大学的Alexander Green团队开发出了一种名为FARSIGHT的计算机辅助设计RNA开关,该技术通过双趾环交换机制,可在15分钟内实现单核苷酸特异性的快速、低背景、多重检测,且无需酶参与。结合等温扩增技术后,FARSIGHT能够在阿摩尔浓度下通过强荧光信号稳健检测单核苷酸突变,并在临床唾液样本中以100%准确度区分SARS-CoV-2 Omicron与Alpha、Beta、Gamma变异株。相关成果以“Programmable fluorescent aptamer-based RNA switches for rapid identification of point mutations”为题,发表于2025年11月21日的Nature Chemistry期刊。论文通讯作者为Alexander A. Green教授和洪帆教授,第一作者为颜兆庆教授。
单核苷酸多态性在众多生物过程中起着关键作用,并与癌症、心血管疾病、传染性疾病及遗传病等多种疾病密切相关。实现SNP的精准快速检测对疾病诊断、预后评估及个性化医疗具有重要意义。然而,现有SNP检测方法普遍存在操作复杂、成本高昂及可扩展性有限等问题。传统方法如等位基因特异性PCR和测序技术耗时费力,且需要专业设备与操作经验。此外,这些方法难以实现实时检测,限制了在床旁诊断和资源有限环境中的应用。基于杂交的替代策略(如toehold probe和超特异性核糖调控器SNIPR)通常通过单次趾环介导的链置换反应释放单链结构域,进而激活报告蛋白翻译或荧光团解淬灭。虽然这些方法提升了检测灵敏度与特异性,但仍面临信号泄漏、读数延迟、荧光标记/淬灭剂或无细胞系统带来的成本压力,以及多重检测能力不足等挑战。
在这项工作中,Alexander Green团队开发了一种基于适配体的RNA开关技术。该技术具备单核苷酸特异性,通过无需酶的检测方法,可在15分钟内实现快速、多元的单核苷酸多态性鉴别。FARSIGHT技术具有多重显著优势:通过利用适配体的独特性质和双趾环交换机制,该技术能以极低背景干扰实现SNP的快速精准鉴别。与传统的单链核酸置换思路不同,FARSIGHT通过多米诺骨牌式分子内反应确保双链结构域的高效释放,进而实现功能适配体构象的重折叠激活。这一创新设计支持通过不同荧光适配体RNA输出实现多重检测,极大拓展了技术的应用场景。FARSIGHT展现出超高的灵敏度,在变异等位基因频率低至0.1%时仍能准确识别单核苷酸变异。此外,这项工作建立了完整的生化模型以阐明FARSIGHT的作用机制。该模型精准捕捉了反应关键步骤,包括两阶段链置换反应及荧光分子结合过程。通过系统研究模拟两步链置换反应化学平衡能对检测分辨力的影响,这项工作为该技术的设计原理与优化策略提供了重要理论依据。

在应用验证方面,研究团队成功在单通道至四通道检测体系中验证其对SARS-CoV-2变异株关键突变位点的检测效能。同时,该技术支持纸基侧流层析试纸条读出模式,为现场检测提供便利解决方案。通过结合等温扩增技术,并建立单管单步(one-pot)反应体系,该检测方法在阿摩尔级别仍保持卓越灵敏度。在临床应用方面,研究团队通过唾液样本的等温扩增同步检测,准确实现了SARS-CoV-2变异株鉴定,充分展示了其在床旁诊断和流行病学监测领域的应用潜力。
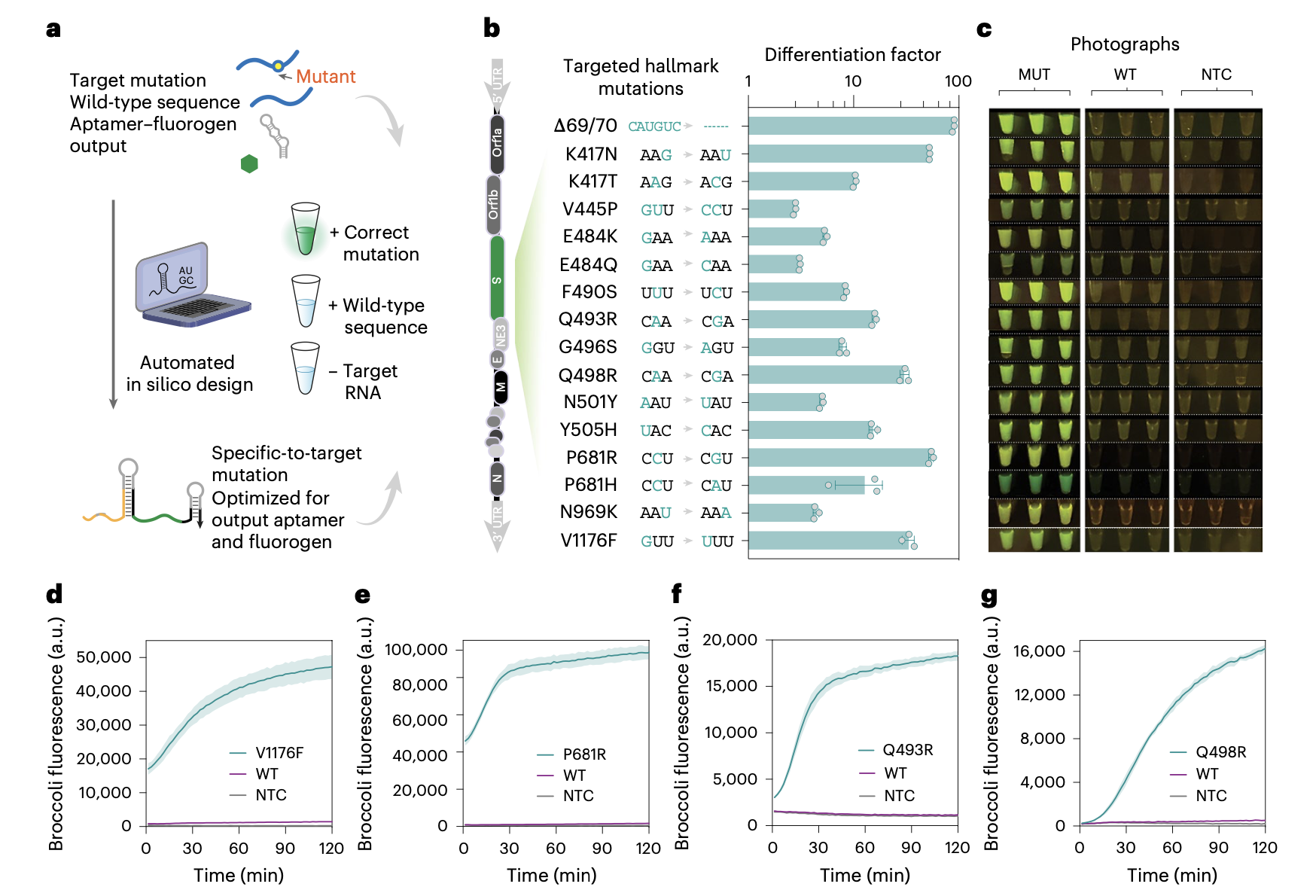
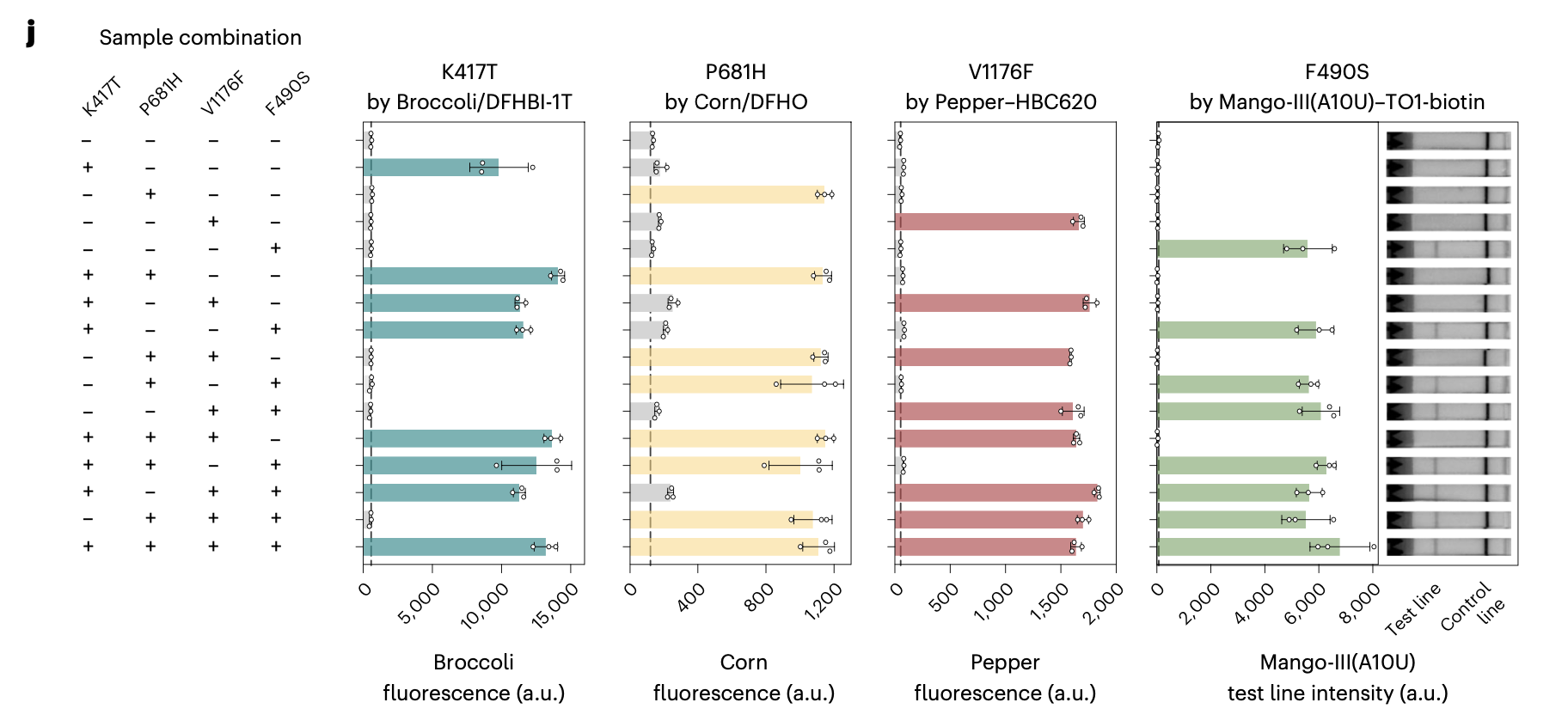
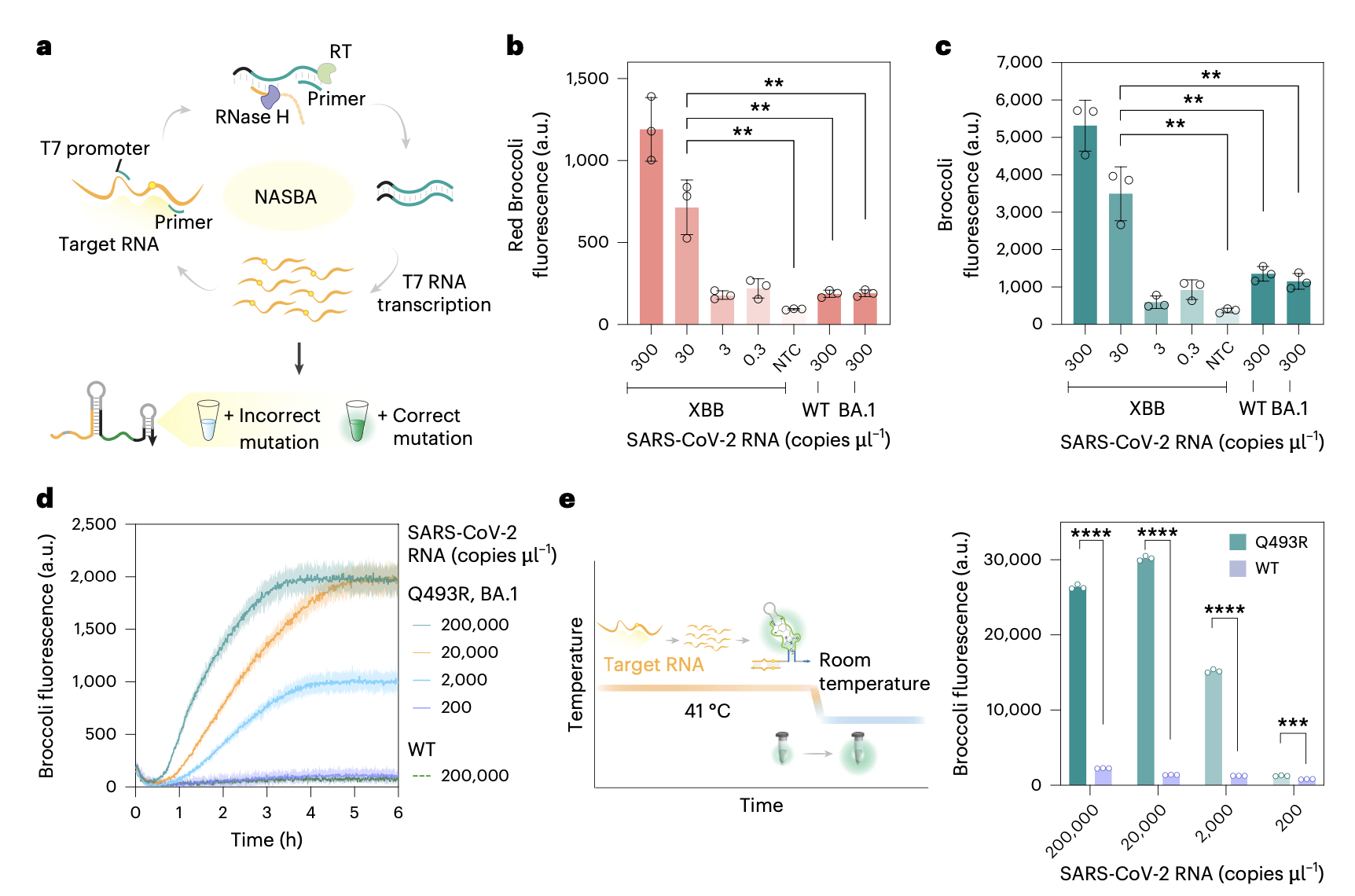
研究人员表示,FARSIGHT技术的创新设计和稳健性能使其在临床实验室、现场流行病学和个性化医疗等场景中具有广阔应用前景。这项技术不仅代表了RNA纳米技术与计算化学领域的重要进展,更为解决当前SNP检测技术的关键局限性提供了新的思路。
(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-025-01995-6