中国科学院上海药物研究所研究员廖苍松课题组与中国科学院天津工业生物技术研究所研究员盛翔课题组合作,利用聚焦理性迭代位点特异性突变(FRISM)策略,对脱羧醛缩酶UstD进行了半理性工程改造,调控了UstD对邻位二酮亲电试剂的区域选择性和立体选择性,获得的工程酶变体具有极佳的选择性和较广的底物谱,拓展了环亚胺酸的结构多样性。1月15日,相关研究在线发表于《德国应用化学》。
复杂手性分子的立体异构体通常具有不同的生物活性,有时甚至表现出完全相反的药理作用。醛缩酶是一种催化C-C键形成的功能强大的酶,在手性药物和精细化学品的合成中应用广泛,但目前利用酶工程调控醛缩酶选择性并应用于非对映异构体多样性合成的研究鲜有报道。
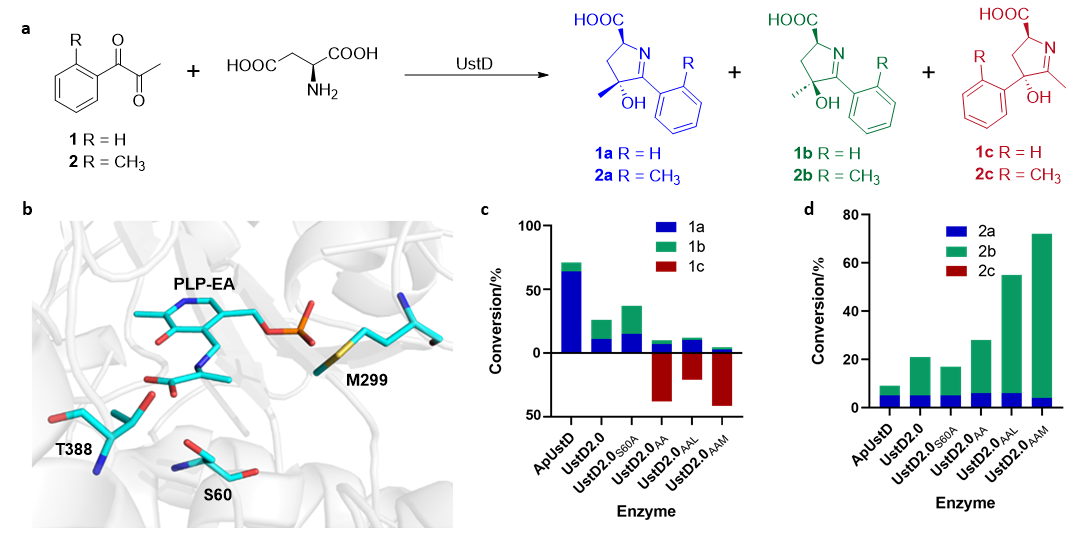
UstD是一种PLP依赖性醛缩酶,负责抗肿瘤环肽化合物Ustiloxin B生物合成途径的最后一步修饰反应。UstD可以催化L-天冬氨酸(L-Asp)与多种亲电试剂之间的脱羧羟醛缩合反应,以高效率和高选择性生成具有γ仲醇或叔醇的非天然氨基酸。
研究人员在之前的研究中阐明了UstD立体选择性和区域选择性的调控机制,发现了Y257和K258对关键烯胺中间体的形成至关重要,而H148则与亲电试剂形成氢键。
 理论计算指导下的UstD工程改造。图片来源于《德国应用化学》
理论计算指导下的UstD工程改造。图片来源于《德国应用化学》
?
在本研究中,研究团队使用FRISM的半理性策略开展酶工程改造研究,通过酶变体设计探索底物结合口袋的残基对选择性的调控机制。经过三轮突变后得到的UstD2.0AAM对产物1c的转化率为46%,选择性为90%,对产物2b的转化率为72%,选择性为94%。
研究人员解析了2b的立体构型,并高选择性地合成了共计30种在α和γ位置具有立体中心的环状亚胺酸,实现了百毫克规模的制备反应,收率达89%。分子动力学模拟研究表明,ApUstD和UstD2.0AAM两种酶活性位点空腔大小和疏水性存在明显差异,这些差异导致了底物在口袋内具有不同的结合构象,也是不同酶表现出不同反应选择性的根本原因。(来源:中国科学报 江庆龄)
相关论文信息:https://doi.org/10.1002/anie.202500080