近日,中国科学院国家纳米科学中心聂广军团队与北京大学第三医院合作,在骨关节炎治疗纳米药物库方面取得进展。相关研究成果以Chondrocyte membrane-coated nanoparticles promote drug retention and halt cartilage damage in rat and canine osteoarthritis为题,在线发表在《科学-转化医学》(Science Translational Medicine,DOI:10.1126/scitranslmed.adh9751)上。
骨关节炎(OA)是常见的关节退行性衰老疾病。OA的特征是关节软骨的进行性磨损、滑膜炎症和病理性软骨下骨重塑,导致患者关节长期慢性疼痛并最终发展为关节功能障碍。目前,OA药物治疗有多种干预手段可供选择,但尚无能够改变疾病进程的治疗方法。因此,多数患者最终需要进行人工关节置换。尽管一些生物制剂和小分子药物如生长因子、基质金属蛋白酶抑制剂和抗炎小分子,在临床前研究中展现出抑制软骨退化的潜力,但由于这些候选药物在临床试验中对患者的益处有限,多数未能转化至临床应用。
OA药物治疗的重要挑战之一是维持软骨组织内有效药物浓度从而长效诱导所需的生物学响应。由于关节软骨无血管的特性,全身系统性给药会导致软骨内药物的分布不足。直接关节腔内注射是增加药物在关节内的生物利用度和最小化全身不良反应的合理方法之一;即使是通过关节腔局部给药,药物会通过关节滑膜毛细血管和淋巴引流迅速被清除,导致药物在关节腔内的滞留时间短暂。而在关节腔内残留的少量药物进一步被关节软骨细胞外基质(ECM)致密的空间结构限制,阻碍了药物向软骨组织内渗透和进一步的软骨细胞摄取。而临床应用需要最小化关节腔内注射频率,以减少引起感染的风险。关节内药物的短半衰期和软骨扩散的不足,限制了OA药物长效治疗的可能性。因此,治疗OA的理想药物递送系统应该能够在被滑膜毛细血管及淋巴管清除之前充分渗透进软骨组织,并能够与软骨ECM内的成分结合,以减少软骨在运动过程中物理变形而排出药物,进而形成软骨特异性药物库以持续进行OA治疗。
该研究受软骨细胞-基质相互作用的特性的启发,利用纳米技术,将含有多种软骨细胞黏附受体的天然细胞膜展示于聚合物纳米颗粒表面(CM-NPs),以构建模仿软骨细胞的纳米药物库,赋予软骨药物递送系统增强的特异性和结合能力。实验结果表明,CM-NPs从纳米尺度模拟了软骨细胞,继承了软骨细胞表面膜蛋白的功能,并主要通过E-钙粘蛋白、网格蛋白介导的内吞及巨胞饮从而具有原代软骨细胞同源靶向性。CM-NPs能够特异性黏附于大鼠及人源退变软骨ECM,并在大鼠软骨组织内滞留超过34天。体外模拟的滑液清除实验表明,负载Wnt信号通路抑制剂的CM-NPs(CM-NPs-Ada)显著下调了炎症条件下大鼠及人软骨移植物的分解代谢活性。在大鼠及比格犬OA模型中,CM-NPs-Ada恢复了模型动物的病理性步态、软骨下骨重塑,并减缓了软骨组织的退变。该团队构建的软骨组织特异性药物储库平台,有望改善抗OA药物的药代动力学以及提升抗OA药物长效治疗的可能性。
研究工作得到国家自然科学基金基础科学中心项目、北京市自然科学基金和中国科学院战略性先导科技专项等的支持。(来源:中国科学院国家纳米科学中心)
相关论文信息:https://www.science.org/doi/10.1126/scitranslmed.adh9751
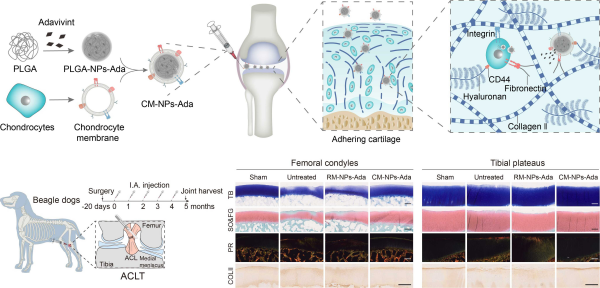
仿生软骨细胞纳米药物制备流程、作用机制和大动物疗效评估
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。