|
|
|
|
|
国家药监局团队提出 “再评估方法” 确保重组生物技术制品安全 Engineering |
|
|
论文标题: Strategy for Viral Safety Risk Reassessment with Changes in the Manufacturing Process of Recombinant Biotechnology Products
期刊:Engineering
作者:赛文博, 贾东晨, 陈昊, 韦薇
发表时间: January 2024
DOI:https://doi.org/10.1016/j.eng.2023.10.003
微信链接:点击此处阅读微信文章
生物技术药物生产中,病毒安全控制策略至关重要,包含预防、检测和清除三个关键要素。生产工艺变更可能影响产品病毒安全性,引发监管重视与重复研究。国家药品监督管理局药品审评中心的研究团队在《Engineering》发表观点述评,提出 “再评估方法” 应对这一问题,有望避免不必要的重复研究,确保产品安全。

研究团队将 “再评估方法” 分为两个层次。若变更不影响病毒安全性,需全面评估已开展研究对变更后工艺的代表性;若可能造成不利影响,则要进行全面或部分重复研究,包括细胞基质检定、关键工艺中间体检定和病毒清除验证。
该方法涵盖三个主要维度。细胞基质方面,如发生变更,需重复所有病毒安全性相关研究,并综合考虑多种因素;关键工艺中间体的检定取决于其代次、污染风险及上游培养阶段变更等情况;病毒去除和灭活工艺性能验证的代表性分析包括验证用样品、缩小模型和指示病毒的代表性。
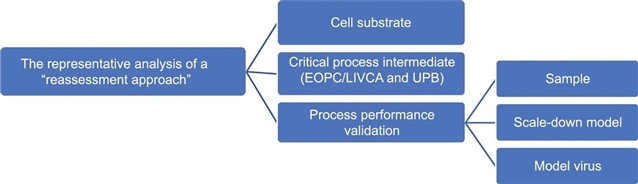
图1 病毒安全性相关研究代表性分析流程。
在工艺性能验证中,验证用样品代表性受活性物质理化特性和工艺中间体特性影响。对于低 pH 孵育工艺、导致杂质变化的工艺变更等不同情况,有相应的验证要求。验证用缩小模型需确保既定条件覆盖拟定生产工艺,不同工艺步骤的最差条件各异。指示病毒选择需考虑工艺特点和宿主细胞潜在风险。
总体代表性分析要系统评估三个维度,根据结果分三种情况处理。部分代表性情况需遵循特定评估原则,同时建议申请人在关键临床试验前锁定生产工艺。
随着生物技术发展,重组生物技术制品工艺变更难免,文章提出的这一再评估策略,为业界和监管机构提供了科学有效的方法,有助于平衡产品优化与风险控制,推动生物技术药物产业安全发展。
文章信息:
Strategy for Viral Safety Risk Reassessment with Changes in the Manufacturing Process of Recombinant Biotechnology Products
重组生物技术制品生产工艺变更的病毒安全性风险再评估策略
作者:
赛文博, 贾东晨, 陈昊, 韦薇
引用:
Wenbo Sai,Dongchen Jia,Hao Chen,Wei Wei. Strategy for Viral Safety Risk Reassessment with Changes in the Manufacturing Process of Recombinant Biotechnology Products. Engineering, 2024, 32(1): 14–17 https://doi.org/10.1016/j.eng.2023.10.003

Open access
开放获取全文
https://www.engineering.org.cn/engi/EN/10.1016/j.eng.2023.10.003
推荐阅读
祝贺!Engineering多篇论文入选2024年中国精品科技期刊顶尖学术论文(F5000)
北京交通大学团队在智能铁路主动安全保障技术研究获重要进展
中国科学院团队:优化紫外高级氧化工艺,实现水中微污染物精准去除
东华大学研究团队:废棉织物变身智能热电气凝胶
Engineering再次入选中国科技期刊卓越行动计划英文领军期刊项目
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。