|
|
|
|
|
科学家研发新型去饱和化酶,解锁烯还原酶的逆反应性实现不对称去饱和化 |
|
|
2024年11月26日,西湖大学叶宇轩课题组在Nature Chemistry期刊上发表了一篇题为“Unmasking the Reverse Catalytic Activity of ‘Ene’-Reductases for Asymmetric Carbonyl Desaturation”的研究成果。
该论文作者解锁了烯还原酶的全新非天然去饱和化反应性,把它们从还原酶改造成为了去饱和化酶。合成了一系列含有远端四级手性中心的高价值环己烯酮产物;此酶催化反应体系条件温和、操作简单、易于放大;系统的机理研究加深了人们对于烯还原酶催化去饱和化过程中重要基元反应的理解。
论文的通讯作者为:叶宇轩;第一作者为王辉,高斌。
α,β-不饱和羰基化合物因其在医药、农业和材料科学中的广泛应用而备受关注。传统化学合成方法虽然多样,但普遍存在多步骤合成、强氧化条件或高催化剂用量等问题,且难以实现立体化学的精准控制。相比之下,酶催化技术以其高选择性、易改造及环境友好等优势,逐渐成为合成化学家关注的重点。然而,天然酶的底物适用范围差有限,阻碍了其更广泛的应用。
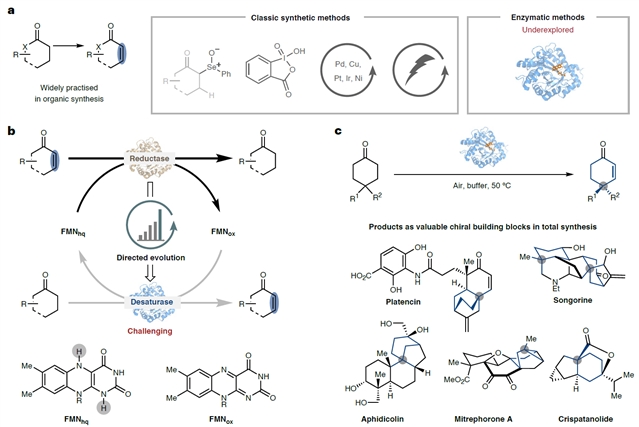
图1:酶催化羰基去饱和化反应。
叶宇轩团队从底物范围广、热稳定性好、易于表达的烯还原酶入手,通过定向进化的力量,成功将其转变为高效的去饱和化酶。研究中,团队首先筛选出两种活性较高的酶CrS和GkOYE,并通过多轮突变优化,提高了它们的催化效率和立体选择性。最终,GkOYE3突变体能在温和条件下,高效催化多种环己酮底物的去饱和化反应,生成具有高对映选择性和非对映选择性的产物。
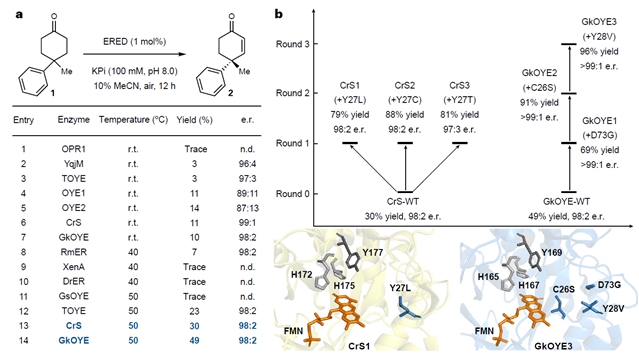
图2:反应优化和定向进化。
作者通过收集定向进化中的有益突变体,建立起去饱和化酶库,并测试了多种4,4-烷基芳基取代的环己酮底物,反应显示良好耐受性。该催化体系展现出对胺和硫醚等敏感官能团底物的良好兼容性。缺电子和富电子杂环、不同烷基取代基底物亦可实现高立体选择性脱氢螺环底物亦转化良好;此去饱和化方法适用于多种取代环己酮底物。二烷基取代环己烯酮25-33可高效去饱和化。即使甲基与乙基微小差异的底物34,未经定向进化仍以62:38er产率获目标产物。单取代环己酮也能顺利实现去饱和化,中等到良好收率和高对映选择性下得产物54-58。
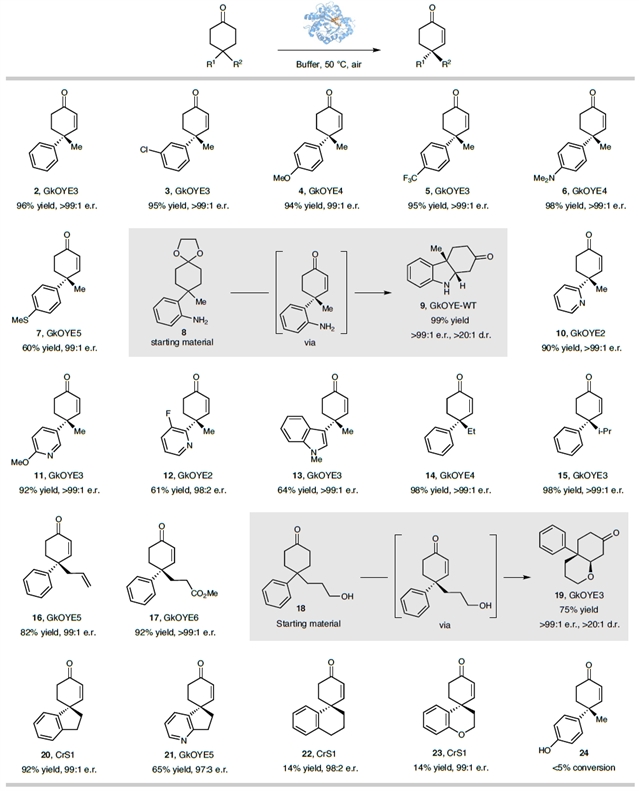
图3:4-烷基-4-芳基环己酮去对称化脱氢反应。
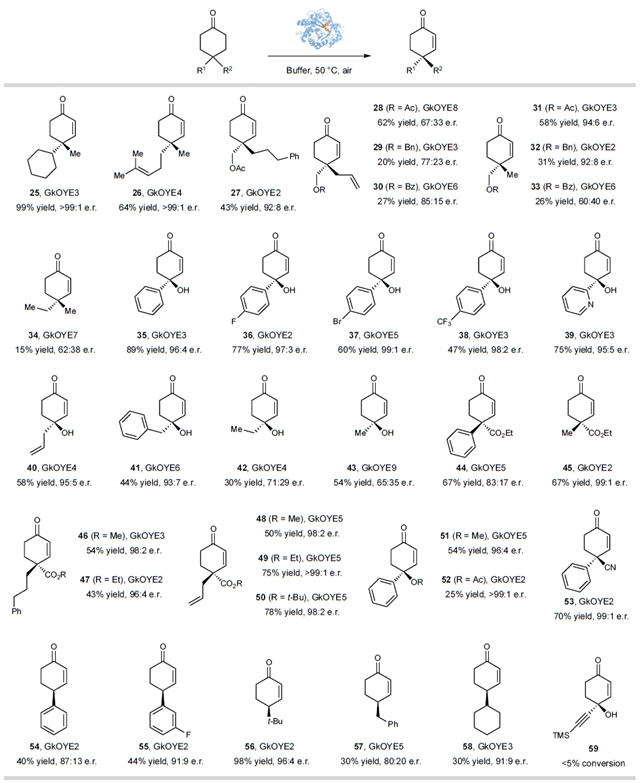
图4:其它类别环己酮的去对称化脱氢反应。
此酶催化反应条件温和、操作简便,易于放大。模型反应在克级规模下(6.0mmol)使用细胞裂解液以88%产率、>99:1er获得产物2;冻干裂解液则为81%产率、>99:1er (图5a)。作者还以克级规模高效制备了(+)-Mesembrine,这是一种血清素再摄取抑制活性的生物碱。环己烯酮产物2作为广泛使用的合成前体,可通过高立体特异性转化成手性化合物62,经过非对映选择性Diel-Alder反应可以生成带三个相邻立体中心的六氢萘酮63 (图5c)。

图5:制备规模合成和产物衍生化。
经过系列的机理实验研究,作者提出了该脱氢反应的机理 (图6)。底物结合于酶的活性空腔后,由保守的酪氨酸残基阴离子 (Y169) 进行α-去质子化,形成烯醇中间体Int1。随后,反应可能通过两条路径进行:路径A中,Int1将β-氢负转移给FMNox,生成去饱和化的烯酮产物2和FMNhq;路径B中,Int1与FMNox进行单电子转移 (SET),产生α-酰基中间体Int2和黄素半醌FMNsq,随后通过质子转移 (PT) 和另一次单电子转移 (SET) 形成2和FMNhq。路径A与ERED催化的天然还原过程相反,遵循微观可逆性原理;路径B则类似于ERED催化的单电子氧化反应。最终,产物2被释放,FMNhq与氧气反应,通过黄素氢过氧化物中间体形成过氧化氢并再生氧化态辅因子FMNox。
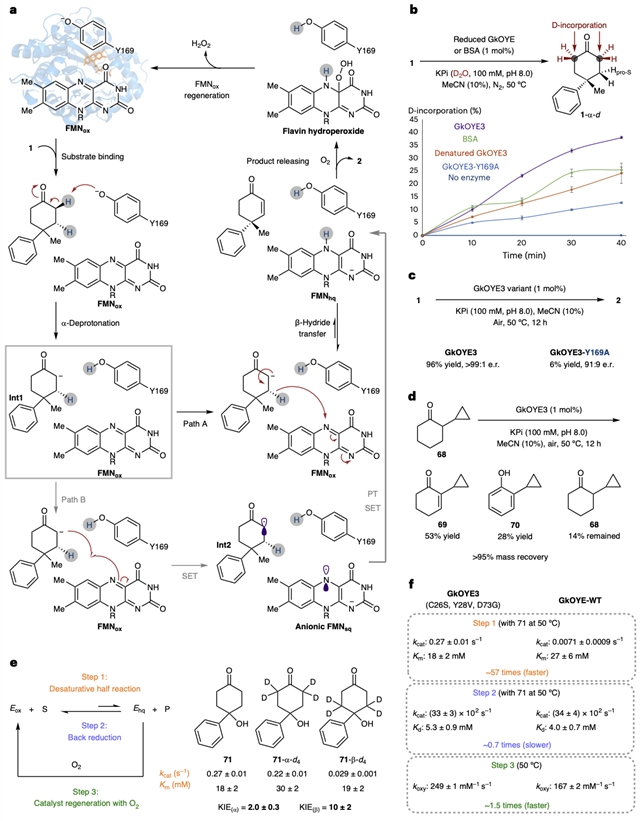
图6:提出的机理,氢/氘交换实验,动力学实验。
叶宇轩课题组成功解锁了烯还原酶的非天然去饱和化反应性,将其从还原酶转变为去饱和化酶。这一创新生物催化平台不仅展现了与现有方法互补的反应性,还拥有卓越的选择性,展现出较好的应用潜力。通过对酶催化机制的系统研究,加深了人们对去饱和化反应机理的理解,为该反应体系的未来发展奠定了坚实的基础。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-024-01671-1