|
|
|
|
|
傅旭东团队揭示溶酶体通过抑制内源逆转录病毒促进胚胎退出全能性的新机制 |
|
|
全能性是指细胞具有分化形成完整个体的分化潜能。在小鼠中,受精后形成的合子与二细胞期胚胎具有严格意义上的全能性,而胚胎在进入四细胞时期后将逐渐退出全能性。胚胎全能性发育过程中伴随着一系列特异性的分子事件,如核子基因组激活等。值得注意的是,许多全能性时期特异性表达的转录本,如Zscan4、内源逆转录病毒MERVL/MT2_Mm等,会在胚胎退出全能性时快速下调。这些转录本的下调对于胚胎退出全能性以及正常发育起到重要作用,但下调的具体分子机制尚未完全揭示。
2024年11月18日,浙江大学傅旭东研究员团队在Developmental Cell上发表了题为Lysosomal catabolic activity promotes the exit of murine totipotent 2-cell state by silencing early-embryonic retrotransposons的研究论文,该研究利用全能性体外研究模型二细胞样细胞(2CLCs),阐明了溶酶体代谢活性可以通过抑制全能性相关的内源逆转录病毒MERVL/MT2_Mm的转录,促进胚胎退出全能性的新功能。

该团队首先发现小鼠胚胎干细胞进入二细胞样状态(类全能性状态)时溶酶体活性下降,同时溶酶体抑制剂处理促进小鼠胚胎干细胞进入二细胞样状态,并且提高了二细胞样状态的稳定性。这些结果表明溶酶体活性可以在小鼠胚胎干细胞中起到抑制全能性状态的功能。
进一步研究发现,溶酶体活性主要通过影响细胞氨基酸浓度去调控全能性。当溶酶体活性增高时,细胞氨基酸浓度上升,并激活下游RagC/D的活性。RagC/D定位于溶酶体膜上,可通过感知细胞内的氨基酸浓度,调控下游转录因子(如TFEB、TFE3)的活性,影响细胞转录。该团队发现,RagC/D激活时,TFEB、TFE3会被招募之细胞质并失活,从而促进全能性特异性转录本(如Zscan4)的下调以及全能性退出。而当溶酶体活性被抑制时,细胞氨基酸浓度下降,RagC/D随之失活,导致TFEB/TFE3进入细胞核,并促进全能性特异性转录本的上调以及抑制细胞退出全能性。
转录因子TFEB/TFE3传统转录调控靶点主要是溶酶体代谢相关基因。但本研究通过CUT&Tag测序分析,发现在全能性状态下,TFEB/TFE3在全能性相关的内源逆转录病毒MERVL/MT2_Mm基因组位点的结合水平增加,并激活这些逆转录病毒的转录,从而影响全能性特异性转录本的表达以及细胞全能性。进一步的数据表明,TFEB/TFE3在MERVL/MT2_Mm基因组位点的结合,主要由MERVL/MT2_Mm的5’端LTR序列的CLEAR moif介导。
该研究同时发现,在小鼠胚胎发育中,溶酶体代谢活性也通过影响胚胎氨基酸浓度调控胚胎全能性的退出。具体结果指出,在小鼠早期胚胎发育过程中,溶酶体代谢活性在胚胎二细胞晚期显著上调。溶酶体活性促进了胚胎内的氨基酸浓度上升,并通过RagC介导了TFE3退出细胞核,抑制了MERVL/MT2_Mm的转录,从而促进全能性特异转录本的下调,以及胚胎退出全能性。而溶酶体抑制剂、抑制RagC活性或转录因子TFE3过表达,均导致小鼠胚胎在二细胞期阻滞,并抑制了全能性特异性转录本的下调。
综上所述,该研究证明溶酶体代谢活性参与了小鼠细胞全能性的调控。溶酶体活性通过影响细胞氨基酸浓度,抑制了二细胞胚胎的内源逆转录病毒的转录,促进了二细胞胚胎中全能性特异性转录本的下调,并促进二细胞胚胎退出全能性(图1)。
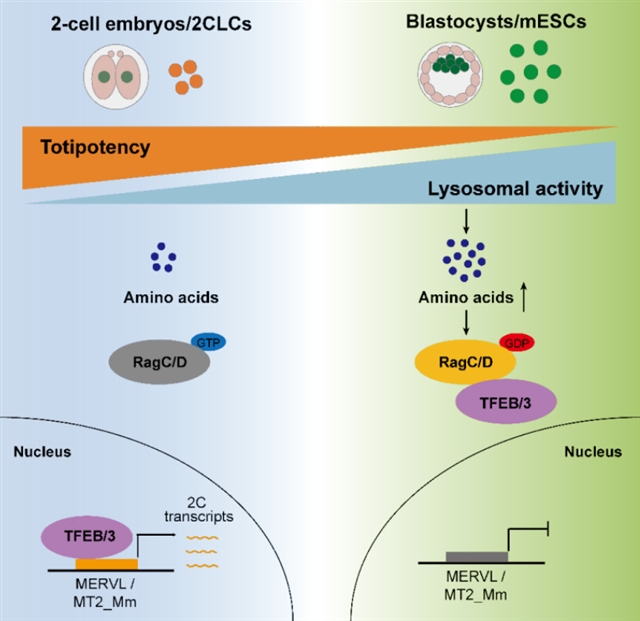
图1:溶酶体活性通过抑制小鼠内源逆转录病毒MERVL/MT2_Mm促进胚胎与细胞退出全能性。
浙江大学傅旭东研究员为本论文通讯作者,博士生吴昊与博士后曹兰蕊为本论第一作者。浙江大学医学院附属第一医院与良渚实验室及为本论文第一与通讯作者单位。该论文参与作者包括浙江大学徐浩新教授、张进教授、叶存奇研究员、张银丽研究员,以及清华大学颉伟教授、博士后嵇姝妍等。该研究还得到了哈佛大学张毅教授、浙江大学刘冲教授、沈宁研究员的指导与帮助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S1534580724006373?via%3Dihub
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。