|
|
|
|
|
彭勃/饶艳霞/毛颖/袁逖飞等人提出验证胶质细胞转分化的基本原则 |
|
|
小胶质细胞-神经元重编程的构想
中枢神经系统(CNS)主要由神经元和胶质细胞组成。与外周组织器官不同,成年后哺乳动物中枢神经系统的神经元几乎不能再生。在神经退行性病变中(如阿尔兹海默病、帕金森病、亨廷顿病和脑中风等),神经元会大量死亡。死亡的神经元无法再生,从而造成不可逆的严重脑功能损伤。与静态的神经元不同,胶质细胞具有一定的再生能力。研究人员提出通过病毒工具操控某个分子,诱导胶质细胞发生重编程(reprogramming;或转分化:conversion),使其分化成神经元,实现神经元的原位再生(in situ regeneration)。从而利用一类可再生的细胞(胶质细胞)补充损失的不可再生的细胞(神经元),实现神经退行性病变的治疗。胶质细胞的重编程现象首先由德国马克斯·普朗克神经生物学研究所的Magdalena Götz教授课题组阐述,他们在2002年报告了PAX6可诱导星形胶质细胞重编程为神经元【1】。随后,一系列研究聚焦在该研究领域,包括德州大学西南医学中心张春立课题组 (SOX2,2013),宾夕法尼亚州立大学的陈功课题组 (NeuroD1, 2014)【2】,HHMI的Marius Wernig和Thomas Südhof课题组 (ASCL1, 2014)【3】等。这些方案均是通过操控单个因子,将星形胶质细胞转变成神经元。虽然星形胶质细胞能够再生,但是其再生能力相对较弱(即使在depletion-repopulation条件下,星形胶质细胞平均每天仅能再生0.7%)【4】。因而,研究人员提出能否通过诱导其他再生能力强的胶质细胞类型重编程为神经元。
小胶质细胞是中枢神经系统内再生能力最强的胶质细胞。复旦大学彭勃课题组前期研究发现,小胶质细胞于再殖条件下,能够通过自我增殖的方式平均每天再生20%的细胞【5】。若是能通过诱导小胶质细胞重编程,那么将相当于发现了一个无穷无尽的补给源,可用来大量补充受损的神经元。来自日本的Kinichi Nakashima课题组,于2019年报道了通过慢病毒异源性表达NeuroD1,可诱导小胶质细胞重编程为神经元【6】。然而,领域内对该现象充满争议。主要争议集中在其原理性上:(1)前人所发现的星形胶质细胞-神经元重编程,两类细胞均是来源于神经外胚层谱系,由radial glia分化而来,亲缘关系较近,可能会发生转分化。而小胶质细胞是由卵黄囊中的髓系细胞发育而来,发育谱系差别很远。若能诱导小胶质细胞-神经元重编程,则这是一类跨谱系的转变,理论上是难以实现的。(2)前人所发现介导星形胶质细胞-神经元重编程的因子(如NeuroD1)均是radial glia分化过程中与细胞命运决定相关的因子。然而,NeuroD1并不表达在小胶质细胞所在的髓系谱系中,跨谱系表达如此重要的先导因子(pioneer factor)能否有相应的下游元件支撑神经外胚层谱系细胞的命运决定亦存疑。同时,近期还存在关于NeuroD1介导的星形胶质细胞-神经元重编程是否是实验假象的重大争议【7】。
来自复旦大学脑科学转化研究院彭勃课题组、复旦大学附属华山医院毛颖课题组和上海市精神卫生中心袁逖飞课题组的研究人员开展的联合攻关,利用活细胞成像、严谨谱系追踪和药理学等多个手段对NeuroD1介导的小胶质细胞-神经元重编程现象进行了系统性探索,相关研究成果于2021年12月6日刊发在神经科学顶级期刊Neuron上,标题为“NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming”(图1)【8】。

图1 论文首页。
证明胶质细胞重编程的三个基本原则
惊人且重大的结论必须进行严谨的求证。在该研究中,研究人员提出了充分证明胶质细胞-神经元重编程所需的三个基本原则:(1)通过严谨的明确的(unambiguous)谱系追踪,设置合理设计的对照组(well-designed control)证明,并排除存在病毒泄漏的可能性;(2)通过明确的(unambiguous)活体/活细胞成像证据,观察到胶质细胞-神经元的转变过程;(3)若是杀掉该类型的胶质细胞,那么该因子所介导的胶质细胞-神经元转分化将不会发生。
首先是谱系追踪,研究人员利用他莫昔芬诱导CX3CR1-CreER::Ai14小鼠的几乎所有小胶质细胞特异性表达tdTomato(永久标记,即使细胞命运发生转变,依然会表达tdTomato)。接下来,通过慢病毒hCAG-NeuroD1-T2A-GFP或hCD68-NeuroD1-T2A-GFP感染小胶质细胞。如果小胶质细胞表达NeuroD1后能够重编程为神经元,那么将能发现一批tdTomato+ GFP+神经元。然而,该团队并没有发现这群双荧光标记阳性神经元的存在(图2)。为了充分验证该现象,研究团队在CX3CR1+/GFP小鼠脑内引进CMV-DIO-mCherryforward-(NeuroD1-T2A-GFP)reverse或CMV-DIO-mCherryforward-GFPreverse慢病毒用来感染脑细胞(图3A)。若是NeuroD1能够诱导小胶质细胞-神经元重编程,则能在第一个病毒处理后观察到GFP+神经元,而作为对照组的第二个病毒将观察不到。然而,不论是通过那个病毒诱导,均能观察到很高比例的GFP+神经元(图3),说明前人所能观察到的“小胶质细胞起源神经元”是来自于实验假象。理论上,在经过他莫昔芬诱导后,病毒仅会在小胶质细胞中发生同源重组,从而表达GFP。但是,研究人员观察到的现象说明利用病毒工具载体进行感染时,会伴随有非特异性泄漏的风险。非特异性病毒泄漏可能会导致对实验结论的误读。
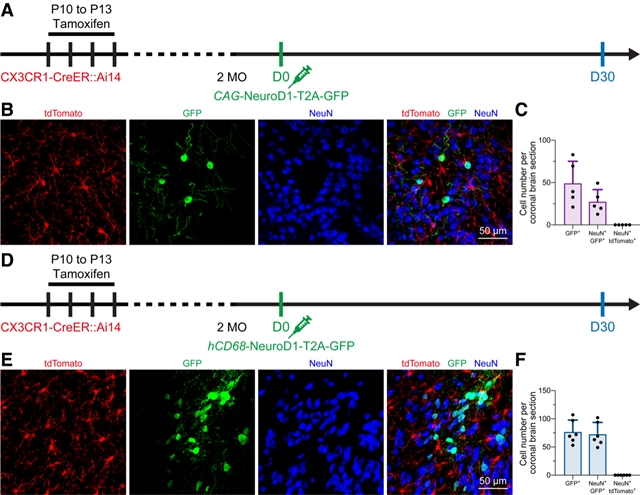
图2 In vivo microglia-specific lineage tracing does not support the microglia-to-neuron conversion.
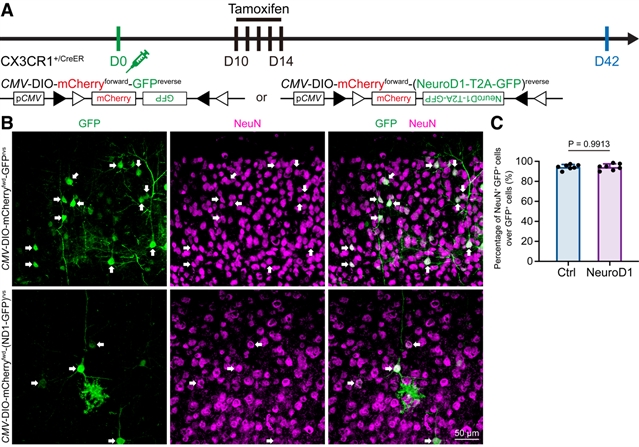
图3 Lentivirus induces non-specific labeling in vivo, which may confound the microglia-to-neuron observation.
在观察小胶质细胞-神经元转变过程方面,研究人员通过活细胞成像方式进行观察,并没有发现表达NeuroD1的小胶质细胞发生到神经元的形态学转变。恰恰相反,研究人员发现表达NeuroD1后,会引起小胶质细胞的大规模死亡。通过BCL2途径可以对抗由NeuroD1小胶质细胞诱导的死亡,说明其NeuroD1不仅不能诱导小胶质细胞重编程,而会诱导小胶质细胞的凋亡。这也很好解释了为何前人和该研究团队观察到的“小胶质细胞转变为神经元”假象的比例很高(图3C,>90%)的原因:成功表达NeuroD1的小胶质细胞诱导发生凋亡而死去,因而最后剩下的细胞大都是非特异性泄漏细胞。
最后,研究人员通过CSF1R抑制剂PLX5622杀死脑内99%的小胶质细胞,发现即使在这种情况下,依然会有很高比例的“小胶质细胞起源神经元”,且比例与不杀小胶质细胞的对照组相当(图4)。因此,研究结果更加确认了前人所观察到的“小胶质细胞-神经元重编程”并非真实情况,而是来自于病毒非特异性泄漏所产生的实验假象(图5)。

图4 Even under microglia depleted brain, the “microglia-converted neurons” are detected, reflecting a lentiviral leakage artifact.
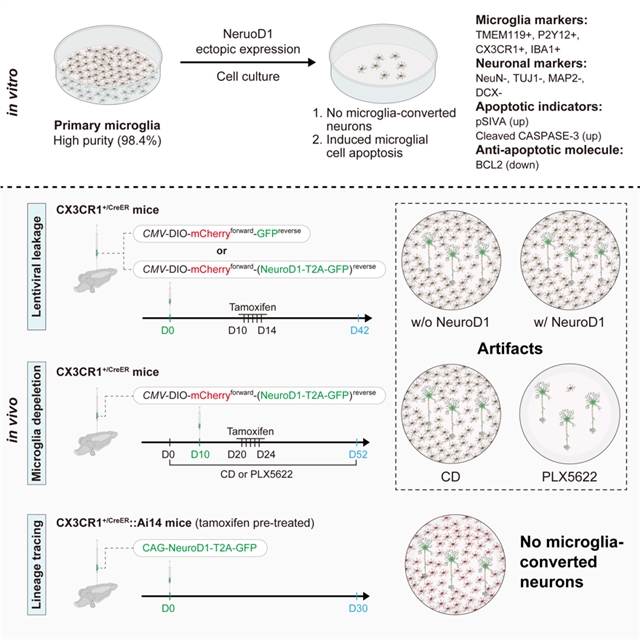
图5 该研究主要结论的总结。
NeuroD1用于防止替换/移植小胶质细胞失控的分子开关
复旦大学彭勃团队利用小胶质细胞的再生能力,开发了三种方案(Mr BMT, Mr PB和Mr MT),首次在全脑尺度上实现小胶质细胞的高效外源性移植/替换【9-12】。该方案可用于治疗由小胶质细胞突变引起的疾病。然而,细胞移植所面临的挑战之一是如何防止外源性细胞失控。在小鼠模型中,常用诱导白喉毒素(DT)表达的方式杀死特性类型的细胞。由于小鼠没有白喉毒素受体,因而死亡细胞所释放出的白喉毒素不会杀死邻近的细胞。然而,由于人类细胞存在白喉毒素受体,因而该方案不能用于临床实践。由于NeuroD1可以诱导小胶质细胞凋亡,因此该研究团队提出通过体外改造的方式,在移植/替换的小胶质细胞中放入诱导表达NeuroD1的元件。一旦移植/替换的小胶质细胞失控,可以通过该分子开关诱导小胶质细胞凋亡,从而提升小胶质细胞替换/移植的安全性。
上海市精神卫生中心饶艳霞博士为该论文的第一作者和共同通讯作者。复旦大学脑科学转化研究院彭勃教授、复旦大学附属华山医院毛颖教授和上海市精神卫生中心袁逖飞教授为共同通讯作者。该团队多人为此研究做出贡献。该研究主要得到了国家自然科学基金优秀青年基金项目、国家重点研发计划、上海市优秀学术带头人项目、上海市基础研究学术特区项目和深圳市知识创新计划的支持。
彭勃课题组目前有青年副研究员(副教授)、博士后、实验室管家的岗位空缺,欢迎对科研充满热情且胸怀学术理想的科研人员/学生加入。申请人请将一份详细的个人完整简历(中英文皆可)通过电子邮件发送至peng@fudan.edu.cn,邮件标题请注明姓名+应聘职位。青年副研究员(副教授)和博士后应聘者请提供两个推荐人的联系方式。(来源:复旦大学彭勃团队)
原文链接:https://www.cell.com/neuron/fulltext/S0896-6273(21)00944-2
参考文献
1 Heins, N. et al. Glial cells generate neurons: the role of the transcription factor Pax6. Nature neuroscience 5, 308-315, doi:10.1038/nn828 (2002).
2 Guo, Z. et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimers disease model. Cell stem cell 14, 188-202, doi:10.1016/j.stem.2013.12.001 (2014).
3 Chanda, S. et al. Generation of induced neuronal cells by the single reprogramming factor ASCL1. Stem Cell Reports 3, 282-296, doi:10.1016/j.stemcr.2014.05.020 (2014).
4 Borges, K., McDermott, D., Irier, H., Smith, Y. & Dingledine, R. Degeneration and proliferation of astrocytes in the mouse dentate gyrus after pilocarpine-induced status epilepticus. Exp Neurol 201, 416-427, doi:10.1016/j.expneurol.2006.04.031 (2006).
5 Huang, Y. et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature neuroscience 21, 530-540, doi:10.1038/s41593-018-0090-8 (2018).
6 Matsuda, T. et al. Pioneer Factor NeuroD1 Rearranges Transcriptional and Epigenetic Profiles to Execute Microglia-Neuron Conversion. Neuron 101, 472-485 e477, doi:10.1016/j.neuron.2018.12.010 (2019).
7 Wang, L.-L. et al. Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell, doi:https://doi.org/10.1016/j.cell.2021.09.005 (2021).
8 Rao, Y. et al. NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming. Neuron 109 (2021).
9 Xu, Z., Peng, B. & Rao, Y. Microglia replacement by microglia transplantation (Mr MT) in the adult mouse brain. STAR Protoc 2, 100665, doi:10.1016/j.xpro.2021.100665 (2021).
10 Xu, Z., Zhou, X., Peng, B. & Rao, Y. Microglia replacement by bone marrow transplantation (Mr BMT) in the central nervous system of adult mice. STAR Protoc 2, 100666, doi:10.1016/j.xpro.2021.100666 (2021).
11 Xu, Z., Rao, Y. & Peng, B. Protocol for microglia replacement by peripheral blood (Mr PB). STAR Protoc 2, 100613, doi:10.1016/j.xpro.2021.100613 (2021).
12 Xu, Z. et al. Efficient Strategies for Microglia Replacement in the Central Nervous System. Cell reports 32, 108041, doi:10.1016/j.celrep.2020.108041 (2020).
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。