近日,中国科学院国家纳米科学中心研究员丁宝全课题组在基于核酸自组装的基因沉默系统用于肿瘤治疗研究中取得进展,相关研究成果以Branched Antisense and siRNA Co-assembled Nanoplatform for Combined Gene Silencing and Tumor Therapy为题,发表在Angewandte Chemie International Edition(DOI: 10.1021/anie.202011174)上。
近年来,基因沉默系统在肿瘤治疗领域的研究已被广泛报道,主要是通过各类阳离子脂质体,高分子聚合物和无机纳米颗粒等为载体递送反义核酸或小干扰RNA,用以沉默肿瘤相关基因,达到抑制肿瘤生长的目的。基于碱基互补配对的核酸自组装体系可被设计成具有不同尺寸和形状的纳米结构,同为核酸的各类基因治疗药物也可以通过碱基互补配对的方式进行共组装,从而使得构建基于核酸自组装的基因治疗系统成为可能。
前期工作中,丁宝全课题组在利用多功能核酸纳米结构递送基因治疗药物领域已获系列进展(Journal of the American Chemical Society 2019, 141, 19032;Angewandte Chemie International Edition 2018, 57, 15486;Nano Letters 2018, 18, 3328)。核酸自组装结构具有尺寸可控、可定点修饰和生物相容等特点,是一类优秀的药物载体。为进一步提高对核酸分子的利用效率,构建一类由核酸药物组成且具有药物载体功效的基因治疗型复合纳米体系较为重要。
在前期研究基础上,丁宝全课题组通过引入小分子偶联的支链核酸药物实现对反义核酸和小干扰RNA的共组装,构建一类既是载体也是药物的基因治疗型核酸纳米复合物用于对肿瘤的联合治疗。研究利用环形的超分子β环糊精为内核经无铜点击反应共价偶联反义核酸序列,制备支链反义核酸(7AS)。同时,对经典的小干扰RNA的3’末端进行延伸,构建出一段能够同反义核酸进行部分碱基互补配对的RNA序列作为碱基识别的连接子(siRNAL)。将支链反义核酸同3’末端延伸的小干扰RNA进行碱基识别并共组装得到核酸纳米复合物。通过超分子体系的主客体识别机制,在基因治疗型核酸纳米复合物中引入金刚烷修饰的靶向性叶酸配体和内涵体逃逸肽,实现对靶标细胞的选择性内化和随后的内涵体逃逸过程。在细胞内RNase H酶的识别和切割作用下,逐步释放支链反义核酸和小干扰RNA,用以对肿瘤相关基因PLK1编码的mRNA进行多位点识别和切割,实现联合的基因治疗,抑制肿瘤细胞的增殖。在小鼠活体水平,该类基因治疗型核酸纳米复合物表现出明显的肿瘤富集效果以及低免疫原性。在1.2 mg/kg的给药剂量下,观测到显著的对肿瘤相关基因PLK1的下调水平,抑制肿瘤的生长。该研究通过构建支链核酸药物,利用核酸自组装和超分子主客体识别,制备具有靶向识别能力和对细胞内特定生物分子产生响应的基因治疗型核酸纳米复合物,实现对靶标基因的精准治疗,为恶性肿瘤等疾病的诊疗提供新的研究策略。
论文第一作者为国家纳米中心副研究员刘建兵,论文通讯作者为丁宝全和刘建兵。研究工作得到国家自然科学基金、中科院战略性先导科技专项、中科院前沿科学重点研究计划等的支持。(来源:国家纳米科学中心)
相关论文信息:https://doi.org/10.1002/anie.202011174
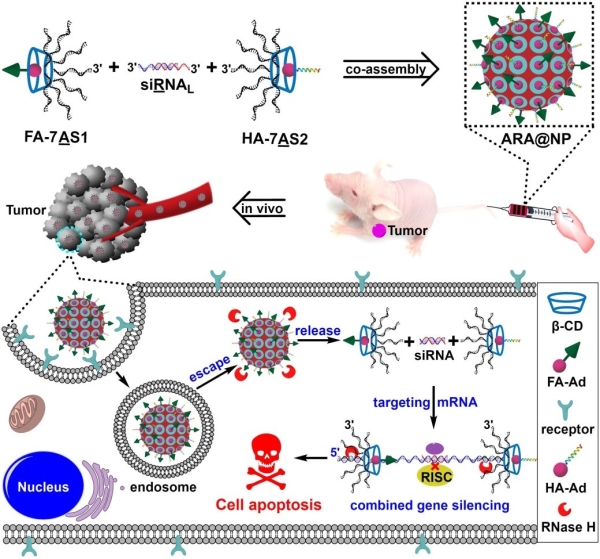
支链反义核酸和小干扰RNA共组装构筑的基因治疗型核酸纳米复合结构,靶向肿瘤实现肿瘤生长抑制
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。