|
|
|
|
|
揭示阿尔茨海默病β淀粉样蛋白原纤维的结构 |《自然-通讯》 |
|
|
论文标题:Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue
期刊:Nature Communications
作者:Marius Kollmer,William Close et.al
发表时间:2019/10/29
数字识别码: 10.1038/s41467-019-12683-8
微信链接:点击此处阅读微信文章
《自然-通讯》本周发表的一篇论文Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue报道了从阿尔茨海默病和脑淀粉样血管病患者脑组织分离的β淀粉样蛋白原纤维的结构。研究结果为理解阿尔茨海默病的结构基础提供了新认识,或有助于相关药物开发。
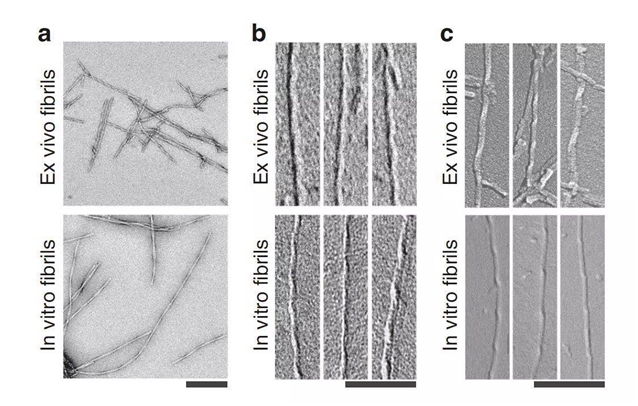
脑源性和实验室制备的β淀粉样蛋白原纤维的不同结构。
图片来源:Kollmer 等
阿尔茨海默病是一种进行性的神经退行性疾病,它的一大特征是β淀粉样蛋白原纤维在斑块和血管壁的沉积。虽然实验室制备的β淀粉样蛋白原纤维在结构上已经得到了很好的表征,但这些纤维在大脑中的结构一直知之甚少。
德国乌尔姆大学Marcus Fändrich和同事在三位阿尔茨海默病患者死后从他们大脑组织中纯化了β淀粉样蛋白原纤维,并用冷冻电子显微镜分析了其结构。作者在所有三名患者的样本中都发现了三种各不相同但结构相关的β淀粉样蛋白原纤维形态,并确定了其中一种形态的分子结构。出乎意料的是,脑源性原纤维的结构与实验室制备的β淀粉样蛋白原纤维的结构差异显著。比如,脑源性β淀粉样蛋白原纤维是右旋折叠,它们的肽折叠方式也与此前分析的原纤维折叠方式非常不同。
该结构突出了表征患者源淀粉样原纤维的重要性。此外,该研究还有助于理解阿尔茨海默病导致的突变对β淀粉样蛋白的影响,或有助于开发防止这类原纤维形成的药物。
摘要:The formation of Aβ amyloid fibrils is a neuropathological hallmark of Alzheimer’s disease and cerebral amyloid angiopathy. However, the structure of Aβ amyloid fibrils from brain tissue is poorly understood. Here we report the purification of Aβ amyloid fibrils from meningeal Alzheimer’s brain tissue and their structural analysis with cryo-electron microscopy. We show that these fibrils are polymorphic but consist of similarly structured protofilaments. Brain derived Aβ amyloid fibrils are right-hand twisted and their peptide fold differs sharply from previously analyzed Aβ fibrils that were formed in vitro. These data underscore the importance to use patient-derived amyloid fibrils when investigating the structural basis of the disease.
(来源:科学网)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。