近日,美国《国家科学院院刊》(PNAS)刊发了中山大学中山眼科中心教授向孟清团队最新成果。他们研究揭示了哺乳动物叉头框蛋白N3(Foxn3)是视网膜纤毛发生关键的抑制转录因子。视网膜特异性敲除Foxn3会导致非感光细胞中纤毛基因的异位表达及纤毛发生异常,进而引发视觉功能障碍,为视网膜纤毛病的治疗提供了潜在干预新靶点。
 Foxn3调控视网膜纤毛生成的作用机制模型。研究团队供图
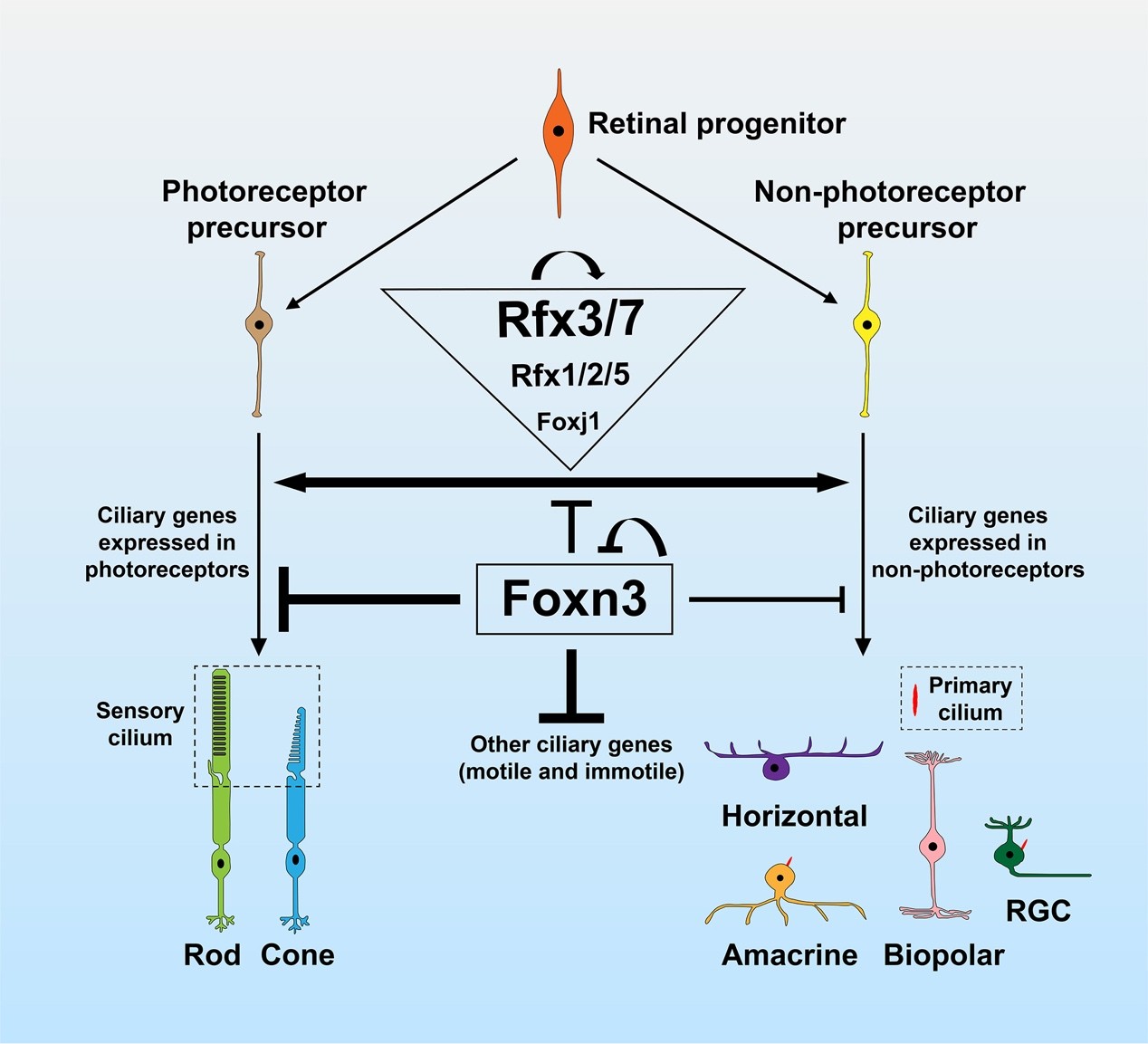
Foxn3调控视网膜纤毛生成的作用机制模型。研究团队供图
?
视网膜作为高度特化的感觉神经组织,由多种细胞构成,在视觉功能中各司其职。其中,视杆细胞和视锥细胞作为光感受器,拥有对光信号转导至关重要的大型复杂感觉纤毛;非感光神经元则仅具备结构简单的初级纤毛。纤毛相关基因突变会引发视网膜色素变性、感光细胞营养不良等多种视网膜疾病。不过,当前多数研究聚焦于感光细胞纤毛发生的调控,对非感光细胞的研究相对较少。
研究伊始,研究团队构建了视网膜特异性Foxn3条件性敲除(Foxn3CKO)小鼠模型,并系统分析了该小鼠发育不同阶段视网膜结构、视神经和视觉功能的变化。结果显示,Foxn3CKO视网膜结构和视神经并无改变,视网膜电图视功能检测发现暗适应下的b波和振荡电位有明显变化,暗适应下的a波和明适应下的检测则无显著差异。进一步探究视网膜细胞命运的特化和分化,发现也无变化,这表明Foxn3不参与小鼠视网膜细胞命运的决定,而是参与其他视网膜光传导结构的调控。
为深入解析Foxn3在视网膜中的功能,团队在国家自然科学基金等项目的资助下,对Foxn3CKO和对照小鼠视网膜进行了scRNA-seq分析。结果显示,Foxn3CKO视网膜中非感光神经元异常激活了大量纤毛相关基因。这些本应在感光细胞中表达的纤毛基因,在双极细胞和无长突细胞中显著上调,如同给信号传导神经元错误装配了感光细胞特有的“信号接收器”,可能导致视觉信号传导异常。
进一步实验表明,Foxn3敲除使视网膜双极细胞和无长突细胞中Armc2、Dnah5等纤毛基因表达显著上调2-100倍。此外,Foxn3CKO视网膜内核层出现大量异位纤毛,双极细胞纤毛数量增加77倍,无长突细胞纤毛数量翻倍。这些异常纤毛与细胞标志物共定位,证实Foxn3缺失不仅引发纤毛基因异常表达,还导致非感光神经元出现病理性纤毛生成。
为揭示Foxn3调控视网膜纤毛发生的基因调控网络,研究团队应用ChIP、CUT&Tag和荧光素酶实验等手段证实:Foxn3作为纤毛基因的转录抑制因子,维持视网膜细胞纤毛分化的二元格局。Rfx家族转录激活因子(尤其是Rfx3和Rfx7)促进感光细胞感觉纤毛的形成,而Foxn3在出生后及成年视网膜中特异表达于非感光神经元,通过双重机制抑制纤毛发生:既直接抑制纤毛基因表达,又通过抑制Rfx基因和Foxj1间接阻断纤毛形成通路。
Foxn3与Rfx转录因子还可能通过自调控网络,精确平衡纤毛基因表达水平,确保感光细胞形成复杂的感觉纤毛,同时阻止非感光神经元产生异常纤毛结构。
相关论文信息:https://doi.org/10.1073/pnas.2500871122
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。