近日,南方医科大学珠江医院方驰华研究团队通过结合纳米技术开发了一种负载地高辛和细胞程序性死亡-配体1(PD-L1)降解纳米纤维的基质金属蛋白酶-2(MMP-2)响应杂化脂质体(D/F@MRL),为肝细胞癌及纤维化实体瘤的治疗提供了新方案。相关成果发表于《控制释放杂志》。
癌症相关成纤维细胞通过促进纤维化和免疫抑制活性在肝细胞癌发生、发展和转移中起着关键作用。因此,寻找克服这一基质-免疫屏障的有效药物组合成为肝细胞癌治疗领域的关键挑战。
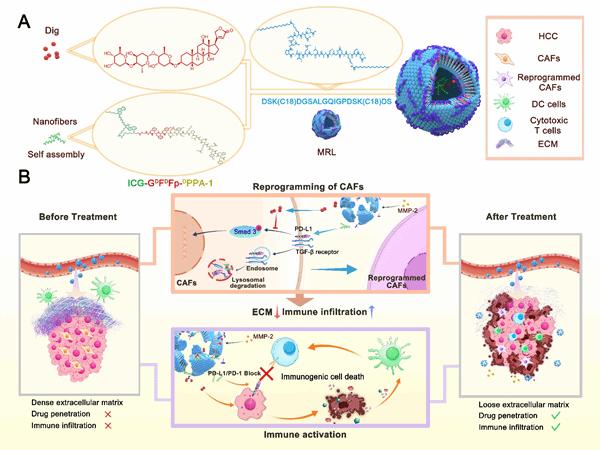 纳米平台构建及突破纤维屏障增强免疫模式图。研究团队供图
纳米平台构建及突破纤维屏障增强免疫模式图。研究团队供图
?
方驰华团队通过调研,确认了地高辛是抑制肝细胞癌进展的潜在药物候选,其不仅可以通过阻滞肿瘤细胞周期进而诱导细胞凋亡,而且产生直接肿瘤杀伤作用。其能够诱导免疫原性细胞死亡,进而促进树突状细胞的成熟,并激活CD8+ T细胞的反应,这一过程增强了抗肿瘤免疫,但是管理地高辛的毒性是其临床应用中的一个重要问题。
基于这一发现,研究团队创新性地结合纳米技术开发了一种D/F@MRL。这是一种基质-免疫协同靶向纳米平台,能够实现癌症相关的成纤维细胞重编程与免疫激活的时空协调。在D/F@MRL中,采用了MMP-2响应型杂化脂质体,共负载地高辛和PD-L1降解纳米纤维。当D/F@MRL遇到富含MMP-2的肝细胞癌基质时,脂质体发生酶切反应,从而使地高辛和纳米纤维在肝细胞癌微环境中靶向释放。
从机制上讲,地高辛抑制了癌症相关的成纤维细胞中SMAD3的磷酸化,而PD-L1的降解使TGF-β受体不稳定,协同沉默TGF-β/Smad信号通路,从而重编程癌症相关的成纤维细胞。这种组合不仅破坏了纤维化屏障,还创造了一个前馈循环,进一步增强了药物渗透,同时加强了地高辛诱导的免疫原性细胞死亡和PD-L1降解驱动的免疫激活。
“我们的研究成果有望为肝细胞癌以及纤维化实体瘤患者带来更精准和高效的治疗方案。”论文通讯作者方驰华表示,这种协同药物策略克服了肝细胞癌中由纤维化引起的免疫抑制,实现了药物在肿瘤微环境中的精准递送,同时在CDX和免疫人源化PDX模型中均展现优异的治疗潜力。
相关论文信息:https://doi.org/10.1016/j.jconrel.2025.113783
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。