|
|
|
|
|
中科院深圳先进院王虹、戴辑团队揭示灵长类体温调节及体温保护机制 |
|
|
近日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所(以下简称“深圳先进院脑所”)/深港脑科学创新研究院(以下简称“深港脑院”)王虹和戴辑团队,在The Innovation杂志在线发表了题为“Primate preoptic neurons drive hypothermia and cold defense”的文章,首次在非人灵长类上实现了基于中枢神经调控的稳定体温调节,揭示了下丘脑视前区在灵长类动物体温调节中的作用,绘制了体温降低过程中全脑特异激活的神经网络,以及灵长类对抗失温的体温保护机制,从而为潜在的临床转化和空间应用提供理论和实验支撑。

图1:文章上线截图(点击“阅读原文”可查看)
2021年Science杂志公布了新版的全球125个重要科学问题。其中一个就是:人类可以冬眠吗?之所以期盼冬眠,原因多种多样。有的希望在冬眠中飞往外太空,有的希望在冬眠中得到生命的延续。但是在现实世界,我们距离人工冬眠究竟还有多远呢?中国科学院深圳先进技术研究院最新的研究成果和你一起解读。
从科幻到科研:体温调控有望点亮人工冬眠
冬眠(Hibernation)是一些物种为了适应极端生存环境,趋同演化出的一种周期性的生理现象。冬眠(连续多日的休眠)与日间休眠(Torpor)的动物,通过抑制代谢率,达到全身水平的低体温、低能量消耗,同时这个过程也伴随着基因表达、解剖结构、生理参数的剧烈变化。在休眠过程中,虽然动物停止进食、饮水等维系生存的必要行为,但是在从休眠中苏醒后,动物继续生存,其肌肉却不发生萎缩。有研究表明,休眠的动物对衰老和辐射有着一定的抵抗作用,似乎休眠“百利而无一害”。
但是动物界中,能自然休眠的动物并不多,其中只包含一种灵长类动物,即狐猴(Lemur)。其他包括人类在内的灵长类动物都不能自然休眠。通过不断研究,科学家希望破解自然休眠动物的奥秘,建立诱发休眠的技术,并在人体中也实现休眠。但是迄今为止,还没有一种“神药”,能在灵长类动物中诱导休眠的现象。
随着神经科学研究的进步,下丘脑视前区(POA)逐渐成为研究热点。在转基因小鼠脑内,特异性激活该脑区神经元,可以促使动物在1-2个小时内降低体温至28℃,并且维持十余个小时低温状态。同时,该调控还促进小鼠增加散热,降低心率和活动量。这个现象与小鼠的天然休眠有类似之处。如果特异激活相同脑区,是否可以在非人灵长类动物中实现定时降低体温甚至休眠呢?
深圳先进院脑所王虹和戴辑团队,利用化学遗传学工具,以非人灵长类动物为模型,展开神经调控体温研究。该团队发现,升高POA脑区一类进化保守的兴奋性神经元的活性,可以促进动物降低体温(如图2)。
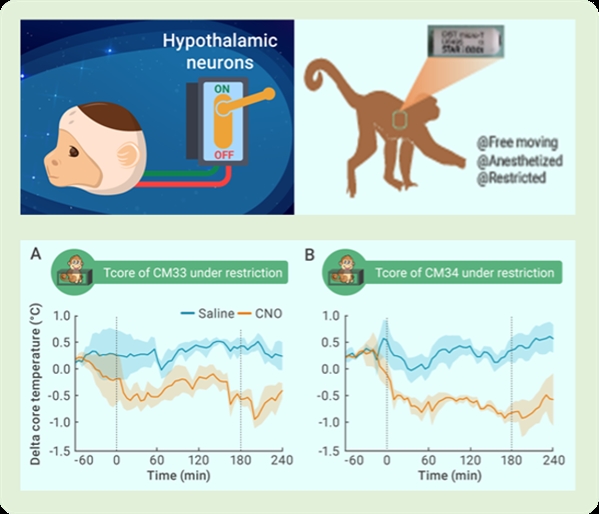
图2:激活猕猴POA神经元降低了体核温度
但是与小鼠存在显著差异的是,非人灵长类动物对体温的变化非常敏感。当体温降低约0.5℃的时候,动物已经通过加速心率、肌肉颤栗、收缩外周血管等自主神经机制产热,拮抗体温的降低。同时动物大幅增加运动量,通过运动产热,抵御体温的降低(图3)。由此可见,非人灵长类动物有着更强的御寒能力,其体温调节机制较小鼠更加精密复杂。仅仅是通过神经刺激单一核团很难达到大幅降低体温的目的。

图3:灵长类为对抗失温而启动一系列体温保护行为
为了进一步了解POA调控体温的脑网络机制,作者还通过功能核磁共振成像的方法评估了POA激活前后全脑水平的神经网络变化,发现化学遗传学刺激方法不仅激活了POA局部网络,也特异地激活了与温度、心率以及内感相关的多个核团(如岛叶皮层IC等,图4),从而绘制了体温降低过程中,全脑特异激活的神经网络。

图4:体温降低过程中全脑功能连接变化
该研究利用化学遗传学手段,通过操控下丘脑兴奋性神经元,首次实现了灵长类动物的可靠体温调节。该研究还探索了灵长类体温调节中枢的功能以及神经网络连接,为潜在的临床转化和空间应用提供理论和实验支撑。
展望
通过降低体温来降低神经元对能量的需求,被证实在中风等脑疾病的小鼠模型中,具有神经保护作用。但是小鼠作为自然休眠的物种,对低温耐受能力很高。休眠中的小鼠体温可以降低至18℃,心率可以降低到日常的30%。如何将基于小鼠的丰富研究成果,推广到体型为其千倍的人类上,还有着漫长的距离。通过非人灵长类动物模型,可以良好的填补这个空白。本研究利用与小鼠相同的神经调控手段,靶向相同脑区的同一类型神经元,成功地调控了非人灵长类动物的体温,为通过降温来保护神经,提供了有益的探索。
尽管这类调节体温的神经元的功能在进化中相对保守,但与小鼠“放弃抵抗”的现象截然不同,非人灵长类动物展示了惊人的御寒能力。这不禁让人联想到20年前硫化氢诱导小鼠进入“假死”状态的报道。当Mark Roth团队报道硫化氢可以诱导小鼠体温降低至10℃,进入“假死”状态后,其本人开设公司,计划利用硫化氢作为诱导人工冬眠的“神药”,助力NASA送宇航员进入火星。但是后续实验纷纷证明,在大型动物中,硫化氢无法诱导低体温现象。硫化氢的故事成为科学研究史中一个典型“炒作”案例。由于小鼠与人亲缘关系较远,加之体型差异巨大,小鼠的体温调节机制很可能与人类不尽相同。通过跨物种的功能研究来解析不同物种之间调控体温的神经环路水平的差异,方能更好地帮助人类了解自己,造福未来。
该研究得到国家自然科学基金委、广东省自然科学基金、中科院青促会、中科院先导、深圳市科创委、深圳市发改委等项目的资助,并受深港脑科学创新研究院支持。
原文链接
www.cell.com/the-innovation/fulltext/S2666-6758(22)00154-0
Zhiting Zhang#, Liang Shan#, Yuyin Wang#, Wenfang Li, Minqing Jiang, Feng Liang, Shijing Feng, Zhonghua Lu, Hong Wang*, Ji Dai*. Primate Preoptic Neurons Drive Hypothermia and Cold Defense. The Innovation, 2023, 4:100358. doi: https://doi.org/10.1016/j.xinn.2022.100358
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。