|
|
|
|
|
4厘米小鱼藏“不死之心” |
|
研究破译斑马鱼心脏再生密码 |
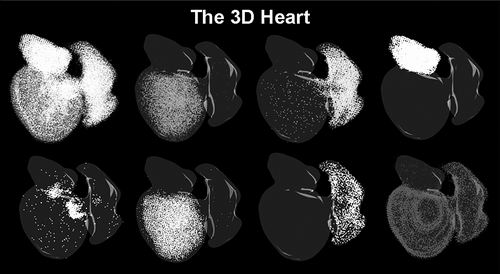
▲斑马鱼的3D心脏影像。

▲苏颖(左一)、赵龙(右一)和团队成员合影。受访者供图
■本报记者 廖洋 通讯员 张慧
在中国海洋大学海洋生物多样性与进化研究所的实验室,一群蓝银相间的热带淡水鱼正在透明的实验水箱中游弋。这群看似十分普通、身形纤细、最长不过4厘米的观赏鱼,就是中国海洋大学教授苏颖和赵龙团队长期研究的核心对象——斑马鱼。
人的心肌细胞一旦受损或缺失,便难以补充、修复。可神奇的是,斑马鱼却拥有一个可再生的心脏。
“它们的心脏在损伤后,可通过一系列细胞生物学事件生成新的心肌细胞及其他类型的心脏细胞,实现结构和功能的完全恢复。”赵龙告诉《中国科学报》,“解析再生过程的细胞动态与分子调控网络,被视为破解心脏再生医学难题的关键突破口。”
为揭开心脏再生的奥秘,中国海洋大学团队联合青岛华大基因研究院潜心绘制了斑马鱼心脏再生单细胞与时空转录组图谱,开创性揭示了心脏再生的分子机制,被国际同行评价为“再生医学领域的重要突破”。近日,相关研究成果发表于《自然-通讯》,并被选为重点推荐文章,编入《临床与转化研究》特刊。
斑马鱼拥有心脏再生的“超能力”
在心脏疾病研究领域,哺乳动物模型是主流。2002年,斑马鱼非凡的心脏再生能力被《科学》报道。
赵龙说:“此次的研究方向就是基于这20多年的积累,并结合近年来飞速发展的空间组学和单细胞组学技术确定的。”
苏颖和赵龙最初接触斑马鱼,还是20多年前在清华大学读研究生时。“在导师孟安明院士指导下,我们当时研究斑马鱼的胚胎发育过程,其中就包括心脏的发育。”赵龙说,后来,他出国进行博士后阶段研究,转向斑马鱼再生方向。
2016年和2019年,苏颖和赵龙先后入职中国海洋大学海洋生物多样性与进化研究所,带着几位研究生开展心脏再生研究。
团队成员或用剪刀切除斑马鱼约20%的心室部分,或用液氮局部冷冻损伤心脏(模拟人类心肌梗死),再将这些心脏受损的斑马鱼放回养殖系统正常饲养。一段时间后,他们发现,前者的心室可以重新长出,并完全恢复心脏结构和功能,后者的心脏经过更长时间,也同样能再生并恢复如初。
这种再生能力,正是人类心脏缺失的“超能力”。
为更加透彻了解这种“超能力”,苏颖和赵龙进一步明确了研究内容,即从时间尺度和空间尺度上,对斑马鱼心脏再生全过程全器官层面的细胞动态与基因表达变化进行系统刻画。
就此,他们走上了对斑马鱼心脏再生“超能力”的探索之路。
破译心脏再生的时空密码
2020年左右,空间转录组技术得到蓬勃发展。在青岛华大基因研究院的支持下,研究团队从2021年起进行初步技术摸索,并陆续产出各个时间点的多组学数据,2023年他们正式进入集中研究阶段。
“我们的研究分3步:厘清斑马鱼心脏损伤前后细胞类型及其分子特征——刻画这些细胞在关键时间点出现的变化,找出对心脏再生特别重要的细胞类型和基因,探究其功能和生物学运行机制。”苏颖告诉《中国科学报》。
研究中,团队借助空间转录组和单细胞转录组这两项“黑科技”,首次构建了斑马鱼心脏再生全过程全器官的、包含时间和空间维度的高分辨率细胞与基因表达动态图谱。
这就像给心脏做了一个动态的“3D基因地图”,不仅能显示损伤修复过程中有哪些细胞和基因活跃或沉默,也能精确定位它们发生这些变化的时间和位置。
依照图谱,结合分子、细胞实验,研究团队锁定了一个名为tpm4a的关键基因。而这个tpm4a基因,恰巧是赵龙的博士论文研究对象,当时他已经解析了其在斑马鱼胚胎期心脏发育中的功能。
研究人员迅速联系孟安明,获得了突变体品系。他们分析发现,心脏受损后,该基因的活性降低,斑马鱼的新生心肌细胞再分化功能显著下降。
为更直观展示心脏再生过程,研究团队利用研究数据构建了具有时间序列的虚拟三维斑马鱼心脏,首次使斑马鱼心脏再生过程中细胞类型、基因表达的时空演变规律得到了数字化呈现。这些数据被收录到公共平台,可供领域内研究人员随时使用,为再生医学研究提供了强大工具与资源支撑。
中国海洋大学团队负责科学问题提出、整体研究方向把控、部分数据的处理及全部的实验验证,青岛华大基因研究院团队则高效完成了数据处理分析工作和三维心脏的构建。双方通过资源与技术互补,合作完成了这一研究。
心脏也能“长回来”?
别看现在研究团队取得了“再生医学领域的重要突破”,但实验室初创时困难重重。
当时,团队里几位研究生都是刚接触再生生物学的新人,生物信息学基础薄弱、心脏再生领域知识匮乏……面对心脏再生领域最前沿的时空组学技术研究,他们只能硬着头皮,一边学习新知识,一边尝试分析数据、摸索研究方法。
论文作者之一、中国海洋大学博士生芦美娜回忆说:“当时遇到最棘手的问题,是把数据分析和相关科学问题结合起来。这不仅需要掌握复杂的分析技术,还得熟悉大量相关的专业知识。”为攻克这个难关,课题组所有人都阅读了海量的文献,从文献洪流中“打捞”出有用的内容。
论文作者之一、中国海洋大学博士生张雪娇负责空间转录组的制样,尤其是在构建3D心脏样品时,需要将一个心脏通切成连续的近200个切片。为最大限度利用空转的芯片,她需要在每一张芯片上贴6至9个心脏切片。由于切片位置不可二次调整,当时刚入学半年的张雪娇反复练习一个多月,最终成功实现191个心脏切片的零失误切割,且全部精准贴在空转的芯片上。
对于整个团队来说,发现tpm4a在心脏再生中的功能只是开始。 通过进一步研究,他们找到了两个可能直接关联心脏可再生能力的关键基因——ifrd1和atp6ap2。这些基因的发现“为临床心血管疾病治疗研究提供了潜在靶标”,也提示后续或许可以通过药物等方式“激活”人类心脏中类似的修复基因,让受损心脏实现再生。
“我们希望进一步挖掘鉴定更多潜在的功能基因和细胞类型,重点关注这些基因与细胞的功能分析与机制研究,寻找并鉴定可能的提高心脏再生能力的靶标,助力心脏再生医学的发展。”赵龙说。
相关论文信息:
https://doi.org/10.1038/s41467-025-59070-0
《中国科学报》 (2025-06-12 第3版 综合)