|
|
|
|
|
区域免疫:八年砺剑,重塑免疫学“版图” |
|
——记国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病” |
编者按
肿瘤、感染、代谢异常、自身免疫性疾病……几乎所有重大疾病都与免疫系统密切相关。过去,免疫学理论主要针对中枢和外周免疫器官开展相关研究,对指导疾病治疗感到力不从心。
中国科学家在国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病”的资助下,首次提出“区域免疫”原创概念,拓展组织器官区域免疫特性及其调控网络的创新研究,揭示区域免疫特性与疾病的内在联系。
该重大研究计划实施8年,科学家不仅重新塑造了免疫学理论的“版图”,也在此基础上开启了疾病防治的新视角。
肿瘤、感染、代谢异常、自身免疫性疾病等一直是影响全球人类健康的重大公共卫生问题,而这些疾病的发生、发展无不与免疫系统相关。想要抓住免疫这个“牛鼻子”治愈这些疾病,离不开基础研究的深刻洞察。
针对过去免疫学理论存在的不足,中国科学家首创提出“区域免疫”概念。自2014年批准立项起,他们在国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病”(以下简称该重大研究计划)的支持下,围绕这一新概念开展深入研究。该重大研究计划指导专家组组长为我国知名免疫学家、中国工程院院士曹雪涛。
近期,该重大研究计划完成结束评估。“在长达8年的研究中,我们拓展了组织器官区域免疫特性及其调控网络的创新研究,并在此基础上发现了免疫治疗新靶点,提出了疾病防治新策略。”该重大研究计划指导专家组副组长、中国科学技术大学生命科学与医学部教授、中国工程院院士田志刚接受《中国科学报》采访时说。
在“区域免疫”新概念指引下,中国科学家重塑免疫学“版图”,开启疾病防治新视角。
原创新概念
“‘区域免疫’的‘区域’有对应的英文单词吗?”“国际上还没有一个英文词汇可以和这个概念画等号。”时间回到2012年4月,田志刚代表指导专家组参加当年国家自然科学基金重大研究计划的预立项答辩会,这段与评委的对话至今让他记忆犹新,也令所有参与该重大研究计划的专家深感自豪。
“区域免疫”这一原创概念的背后,是中国科学家对人民健康重大需求的深刻把握,以及对免疫学前沿的创新洞察。
淋巴细胞是免疫系统的关键组成部分,可以在骨髓、胸腺、淋巴结、脾脏等不同的组织和器官之间迁移与定居,从而形成一种循环机制,使其能够遍历全身,寻找并响应各种病原体的出现——这便是经典的“淋巴细胞再循环”理论。
一直以来,“淋巴细胞再循环”理论在免疫学家心中的地位同分子生物学的“中心法则”一样重要。然而,随着对免疫系统理解的深入,基于免疫学经典理论指导疾病诊治的局限性开始显现。田志刚指出:“它集中关注‘专职’免疫器官,却忽视了肝脏、肺、肠道等疾病高发的组织器官,而这些恰恰是免疫应答最活跃的前线器官。”
科学家相信,这些“非专职”免疫器官不仅具有自身特异的免疫细胞组成和独特的免疫学特性,还可以与其他免疫组织相互作用,对疾病的发生和发展起到至关重要的作用。
早在2008年,田志刚带领的科研团队就注意到肝脏复杂且独特的免疫学特点。他们与国际合作者在《肝脏病学》发表了一篇具有划时代意义的论文,提出“肝脏不仅仅是代谢中心,更是免疫活动的关键场所”这一论断。这项工作既是对肝脏经典功能的挑战,也激发全球科学家对“非专职”免疫器官特性与疾病的关系进行深入思考。
2012年2月15日,中国免疫学会常务理事会召开“免疫学发展战略”研讨会,免疫学遇到的前述挑战成为热议话题。专家一致认为,要将视野拓宽到“非专职”免疫器官上,并决定将它们发挥的作用称为“区域免疫”。
此后,基于多轮学术研讨会的充分讨论,加之吸纳全球专家的意见,科学家向国家自然科学基金委员会提出重大研究计划申请,并于2014年底顺利立项。
科学家将“区域免疫”概念的意义总结为“三前”。第一是“疾病前沿”。“疾病在哪个器官中发生,免疫学的研究就应该聚焦哪个器官,这意味着我们对疾病的认识一下子到了前沿。”田志刚解释说,过去以“专职”免疫器官的数据推断疾病发生器官病理变化的做法存在较大偏差。
第二,回到免疫学的“前哨阵地”。从胚胎发育过程来看,起源于中胚层的骨髓、胸腺、淋巴结、脾脏等专职免疫器官为机体内封闭系统,不与外环境直接接触;起源于内外胚层的呼吸、消化、神经、皮肤等“非专职”免疫器官为机体对外开放系统,与外环境直接接触,是免疫应答最活跃、最频繁的区域。
第三,“区域免疫”概念还有望促进免疫学理论的更新和完善,成为免疫学理论的“前导”。
“顶天”又“立地”
做“顶天”“立地”的基础科学研究,是科学家的共同追求。这要求他们既要在理论上取得新突破,也要解决临床中的实际问题。
令人欣慰的是,8年耕耘,中国免疫学家实现了这个愿景。
在“顶天”方面,科学家通过一系列科学实验,为“区域免疫”概念提供了坚实的数据支持。这些实验的结果不仅验证了“区域免疫”的真实性和有效性,而且在多个维度补充和完善了传统免疫学理论框架,改写了经典教科书。
田志刚介绍,以肝脏区域免疫为例,在该重大研究计划支持下,科学家验证了肝脏发挥了免疫器官的作用,揭示了肝脏与脾脏、肠道、肺等其他器官之间复杂的免疫交互网络,并发现了肝脏中全新的免疫细胞群体。
“免疫学上,新发现的免疫细胞总是被视为‘皇冠上的明珠’。”田志刚表示,“我们在该重大研究计划支持下识别并解析了全新免疫细胞,不仅填补了免疫学领域的空白,还为理解肝脏免疫机制乃至整个免疫系统的工作原理提供了新视角。”
科学家还揭示了肝脏免疫耐受新机制,并大力推动一系列基础研究的新进展转化为精准医疗策略。
肝癌细胞会利用肝脏固有的免疫耐受的特性,通过诱导额外的免疫抑制机制,逃避免疫系统的识别和清除,得以生长和扩散。
在该重大研究计划支持下,科学家们还发现新的细胞亚群“CD49a+NK细胞”及其在肝脏免疫稳态中的作用机制。田志刚介绍:“在暴发性病毒性肝炎模型中,这些细胞如同‘裁判员’,可防止全身T细胞过度激活,避免肝损伤和肝衰竭的发生。”科研团队据此开发了针对CD49a+NK细胞的抗体药物,旨在通过调节其功能,恢复肝脏的正常免疫监视能力,抑制肿瘤生长。
在此基础上,科研成果快速向临床应用转化。在2022年至2023年的一年内,3种基于CD49a+NK细胞的有关TIGIT家族靶点的创新药物获批进入中国和美国的临床试验,实现了从基础研究到临床应用的成功跨越。
此外,该重大研究计划支持的多项科研成果实现技术转让或进入临床试验。比如,抗乙型肝炎病毒的模拟抗原疫苗进入III期临床试验,开发“人外周血NK细胞体外扩增试剂盒”产品并开展非注册临床试验研究,研发出我国首个新冠病毒治疗性中和抗体药物,开展托珠单抗治疗视神经脊髓炎的多中心临床试验,开展治疗耐多药肺结核病的临床研究等。
“揭榜挂帅”联合攻关
在指导专家组看来,该重大研究计划在管理方面积累了许多经验,为实现科学目标提供了基础保障,对于其他大型科研项目具有借鉴意义。
该重大研究计划自启动之初便注重顶层设计,确立了明确的战略目标和研究方向,确保研究工作的前瞻性和系统性。
具体做法是,指导专家组通过认真调研,识别国内在特定领域具有潜力的科研团队,主动邀请他们参与。“这种类似‘定点制作’或‘揭榜挂帅’的方式,确保了我们能够吸引到最合适的科研力量。”田志刚说。
该重大研究计划实施早期,专注单细胞组学研究的北京大学生命科学学院教授张泽民就是通过这样的方式特邀加入的。
在张泽民带领下,该重大研究计划成立了“单细胞组学联合攻关小组”,会集了北京大学、清华大学和浙江大学的专家,共同攻克单细胞技术难题,取得了重要学术成果。因为这些成果广受学术界认可,张泽民于2023年当选为中国科学院院士。
指导专家组认为,“主动出击”不仅带来了技术创新,而且促进了多学科交叉合作,推动了重大科研成果产出。
同时,指导专家组高度重视项目组之间的交流,抓好年度交流会和专题研讨会这两个关键环节。年度交流会上,承担科研项目的负责人分享研究内容,指导专家组进行现场点评,以总体把握未来研究方向及促进研究项目进展。同时,年度交流会还特别邀请2至3位非免疫学领域的专家作大会报告,鼓励学者积极开展学科交叉研究。
专题研讨会则深入讨论特定领域的核心问题,强化目标导向。该重大研究计划实施期间,曾组织召开过聚焦肝脏、肠道或肺的区域免疫研讨会,还以“免疫光子学”这类先进技术为主题举办培训班。
“这些会议推动了研究成果的深化,为实现原始创新搭建了高效平台。”田志刚强调。
此外,指导专家组还通过组织、参加国际免疫学大会、美国免疫学大会、冷泉港亚洲会议等国际会议,扩大中国免疫学研究的国际影响力。
面向未来,免疫预防和免疫治疗正在改变全球生物医药格局,成为重大疾病源头防治的重要手段。
指导专家组一致认为,领域内专家学者应立足区域免疫研究的中国优势,创建组织器官区域免疫理论新体系和新技术,创新多学科交叉研究新范式,促进基础研究和临床转化紧密结合,服务健康中国战略。

指导专家组组织“免疫光子学”研讨会。
“定居肝脏”的自然杀伤细胞的发现
自然杀伤细胞(NK细胞)是固有免疫系统的重要成员,被誉为肿瘤和病毒的“天生杀手”。
科学家以往对NK细胞的研究以骨髓、胸腺、脾脏、淋巴结等“专职”淋巴器官和血液为主体,但这些部位与疾病高发组织器官的免疫特性相差甚远。在国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病”支持下,我国学者发现了“定居肝脏”的NK细胞,由此对肝脏区域免疫特性进行深入解析,为了解肝脏疾病发病机理和促进治疗带来新突破。
中国科学技术大学免疫学研究所科研团队发现肝脏富含CD49a+NK细胞,该NK细胞占肝脏总NK细胞的一半,不参与血液循环,长期“定居”在肝脏组织中,被学界称为“1型固有淋巴细胞”,与循环NK细胞有显著差异,提示肝脏存在两套不同的NK细胞。
与循环NK细胞依赖于骨髓造血的经典理论不同,肝脏定居NK细胞起源于胚胎肝脏并在成年肝脏中继续成熟、终身维持。该NK细胞生理状态下行使对免疫应答的负相调控,通过免疫耐受避免过度免疫损伤。例如,嗜肝病毒(如巨细胞病毒)可诱发暴发性肝炎,导致肝衰、死亡。该细胞可以通过细胞表面免疫负调分子PD-L1与抗病毒T细胞表面PD-1结合,抑制T细胞抗病毒免疫应答,使该T细胞的攻击行为“适可而止”,避免机体“杀敌一千自损八百”。与之相反,他们还发现某些嗜肝病毒(如乙肝病毒)可利用该NK细胞的负调特性,使之“助纣为虐”,以便病毒逃逸免疫攻击并造成慢性持续感染,最终导致肝癌。这提示该NK细胞参与了许多肝脏疾病的致病过程。
中国科学技术大学免疫学研究所教授彭慧介绍,肝脏是疾病高发器官,免疫系统稳态是肝脏正常行使功能的保障,长期以来,针对肝脏局部免疫细胞的特性研究相对缺乏,导致对肝脏疾病的机制认识不够深入和全面。NK细胞在肝脏中含量丰富且与其他组织器官NK细胞差异巨大,以NK细胞为窗口进行研究,对深入了解肝脏免疫学特性以及肝脏重大疾病的机制具有重要意义。
肝脏定居NK细胞新亚群的发现、溯源和功能验证,表明肝脏可以独立于骨髓“制造”出表型和功能独特的免疫细胞新群体,这些细胞可在慢性病毒感染过程中抑制T细胞抗病毒应答,导致感染迁延不愈乃至肝癌发生。采用抗体靶向肝脏定居NK细胞表面负调分子PD-L1,可解除对T细胞的免疫抑制,有利于机体清除病毒和治疗肝癌。
上述研究表明,肝脏不仅是代谢器官,也可以作为骨髓外的造血组织塑造出独特的区域免疫耐受属性。
学者认为,聚焦疾病多发组织的免疫属性研究,与传统免疫学教科书主体所描述的专职免疫器官研究互补,由此发现的组织定居NK细胞新亚群和新功能,为NK细胞生物学和肝脏免疫学研究提供了新生长点。尽管取得了一系列进展,组织定居NK细胞仍然是有待深入挖掘的新领域。

彭慧(左)在研究中。
三级淋巴结构助力乳腺癌新辅助治疗
新辅助治疗是在手术前对患者进行放/化疗,具有缩小肿瘤有利手术、判断药敏及时换药、评估预后等多重优势。作为国内最早开展乳腺癌新辅助治疗的中心之一,中山大学孙逸仙纪念医院研究团队在多年的临床实践中,发现该治疗策略不仅能让患者临床获益,还能通过对比治疗前后的组织标本,动态观察治疗前后肿瘤免疫微环境发生的真实变化。
在国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病”支持下,中山大学孙逸仙纪念医院主任医师苏士成带领科研团队发现,新辅助化疗前,乳腺癌临床样本中免疫细胞浸润较少,而新辅助化疗后,部分疗效好的患者肿瘤中出现了完整结构的免疫细胞簇,即三级淋巴结构。
科研人员介绍,这一结构形成于非淋巴组织中的异位淋巴样器官,常位于慢性炎症部位,包括自身免疫疾病、感染性疾病和肿瘤等。同时,三级淋巴结构与淋巴结等淋巴器官有相似的结构,也包含T细胞、B细胞、滤泡树突状细胞等多种免疫细胞,具有特殊脉管系统。因此,三级淋巴结构可以作为免疫细胞进入肿瘤组织的通道。多项研究结果表明,肿瘤三级淋巴结构与患者的预后呈正相关。
研究团队借助前沿的单细胞测序技术,聚焦于B细胞表型,对新辅助治疗前后乳腺癌患者的临床样本进行了精细对比。这一创新性探索,揭开了肿瘤微环境中一个具有独特特征的全新B细胞亚群的神秘面纱。其中,肿瘤微环境中浸润的ICOSL+B细胞数量与化疗效果之间呈现明显的正相关,为评估化疗响应性提供了新视角。
区域亚组织分析发现,该B细胞亚群更倾向于定位在化疗后形成的三级淋巴结构中,并且与T细胞直接接触。
为了探索这群B细胞的功能和产生机制,团队利用cas9技术,通过重组酶系统建立了B细胞特异的条件性基因敲除小鼠模型。实验结果表明,肿瘤细胞经化疗药物处理后,其表面的磷脂酰丝氨酸可以通过激活补体系统,活化B细胞。激活后的B细胞发生表型转换,通过表达ICOSL分子,能够诱导CD4+和CD8+ T细胞分别向辅助T细胞和细胞毒性T细胞分化,促进抗肿瘤免疫反应,从而协同增强机体的抗肿瘤免疫应答。
这项研究鉴定了三级淋巴结构中重要的抗肿瘤B细胞新亚群,并阐明了化疗诱导的肿瘤细胞免疫原性死亡引发的补体信号是诱导这类细胞亚群产生的关键机制。研究人员相信,这一发现为评估化疗诱导的抗肿瘤免疫反应强度提供了潜在的新型生物标志物,为癌症治疗策略的制定提供了理论依据与实践指导。
这项研究成果在《细胞》发表。另据同时期的《自然》发表的3篇临床研究文章,三级淋巴结构B细胞是多种癌症免疫治疗获益的最强预测因素。
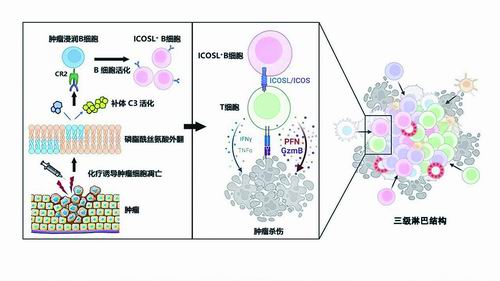
研究鉴定了三级淋巴结构中重要的抗肿瘤B细胞新亚群。
单细胞组学解码泛癌肿瘤微环境中的T细胞
T细胞是最关键的抗肿瘤免疫细胞。肿瘤微环境中存在 “肿瘤浸润T细胞”亚群,能够对肿瘤抗原产生反应,肩负着清除肿瘤细胞的重任,也是摧毁癌细胞的“主力军”。然而,随着肿瘤发展,这些英勇的“战士”常常陷入功能失调状态,“战斗力”大幅下降,被科学家称为“T细胞耗竭”。
越来越多的证据表明,不同癌症的肿瘤微环境对T细胞的组成和状态发挥着重要作用。作为一种创新工具,单细胞转录组测序(scRNA-seq)技术已在多种癌症中广泛应用,以精准解码肿瘤微环境的复杂网络。但迄今为止,仍然缺少对不同类型癌症T细胞在单细胞水平进行的系统比较分析。
为更好了解肿瘤浸润T细胞的全貌,在国家自然科学基金重大研究计划“组织器官区域免疫特性与疾病”支持下,北京大学生命科学学院教授、中国科学院院士张泽民课题组利用单细胞组学技术,揭示了癌症间的共性和特殊性。
科研人员在这项研究中获得了多个癌症的T细胞数据,包括骨髓瘤、淋巴瘤、肾癌、卵巢癌、子宫内膜癌、食道癌、甲状腺癌、乳腺癌、胃癌和胰腺癌,并广泛收集领域内已发表的类似数据。他们创新生物信息方法,有效整合不同实验平台和实验室来源的数据,构建了单细胞水平的“泛癌症T细胞图谱”。图谱涵盖了来自21种癌症类型的316个个体样本的高质量T细胞数据。科研人员共鉴定出17个CD8+T细胞类群和24个CD4+T细胞类群。
基于该图谱,研究人员分析了耗竭T细胞的异质性,并解析了肿瘤患者CD8+T细胞耗竭的不同途径,及其在癌症间的差异。在大多数肿瘤内,耗竭T细胞由效应记忆T细胞和组织驻留记忆T细胞分化而来。研究人员还系统揭示了CD8+T细胞耗竭的转录调控机制。肿瘤微环境可显著重塑T细胞状态。分析表明,肿瘤微环境中的干扰素和TGFβ等信号对耗竭T细胞的表型具有重要作用。此外,科研人员还探究了多种因素与肿瘤浸润T细胞组成的复杂关系,证实肿瘤的突变负荷总量以及具体的基因突变都能够影响肿瘤浸润T细胞。
基于这些基础科学的新认知,科研人员创造性地提出一种基于肿瘤浸润T细胞组成特征的免疫分型策略,旨在对癌症患者的免疫状态进行精细评估。数据显示,不同免疫分型与患者生存、免疫治疗响应等临床特征显著相关。
上述研究成果在《科学》发表。科研人员期待,单细胞水平的泛癌症T细胞研究能在多方面加深人们对肿瘤浸润T细胞的认识,并促进创建新的癌症免疫疗法。
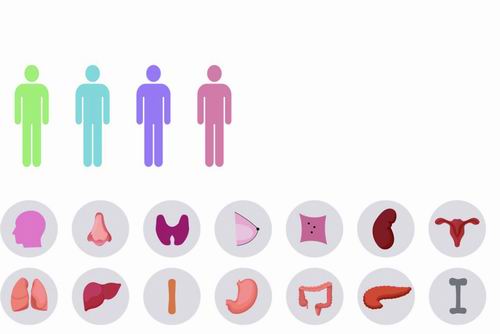
“泛癌症T细胞图谱”涵盖来自21种癌症类型的316个个体的高质量T细胞数据。
(本版内容由本报记者甘晓采写,图片由研究团队提供)
《中国科学报》 (2024-07-30 第4版 自然科学基金)