|
|
|
|
|
用于头颈癌研究的棉尾兔乳头瘤病毒 (CRPV) 相关动物模型:文献综述 | MDPI Viruses |
|
|
论文标题:Cottontail Rabbit Papillomavirus (CRPV) Related Animal Models for Head and Neck Cancer Research: A Comprehensive Review of the Literature
论文链接:https://doi.org/10.3390/v16111722
期刊名:Viruses
期刊主页:https://www.mdpi.com/journal/viruses
研究背景
拥有合适的动物模型对于模拟人类疾病状态以及将实验数据成功转化为临床实践至关重要。在乳头瘤病毒研究领域,家兔 (Oryctolagus cuniculus) 作为不可或缺的模式生物已有近100年的历史。首次对家兔乳头瘤病毒的鉴定和表征、其致癌潜力和免疫原性的研究,极大地促进了人们对乳头瘤病毒遗传学和生命周期的总体认识,并推动了疫苗接种等抗病毒策略的发展。由于乳头瘤病毒具有高度的物种特异性,只有兔乳头瘤病毒 (RPVs) 可用于兔乳头状瘤性肿瘤疾病的动物研究。
来自德国马尔堡大学解剖学与细胞生物学研究所的Michael Bette教授及其团队在 Viruses 期刊发表了文章,介绍了棉尾兔乳头瘤病毒 (CRPV) 相关的兔鳞状细胞癌 (RSCC) 和实验用RSCC肿瘤的发现和产生的历史。全面概述了目前基于CRPV相关VX2癌的肿瘤模型,重点介绍了人类头颈部鳞状细胞癌 (HNSCC) 肿瘤模型,并讨论了这些肿瘤模型在通用于人类HNSCC方面的优势。
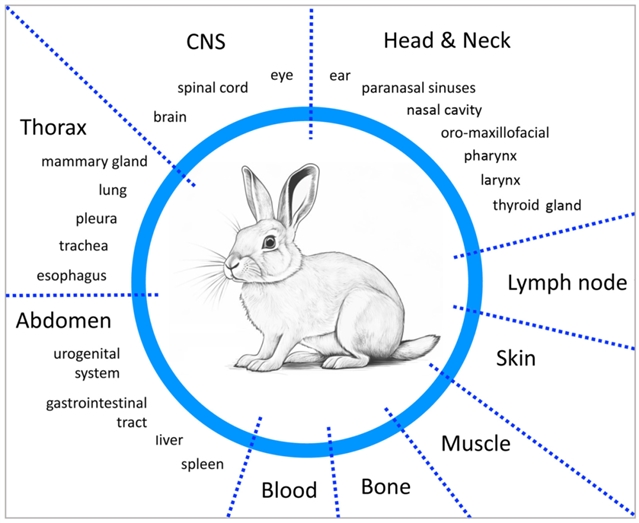
按身体部位和器官分组的VX2肿瘤兔模型的描绘。
研究简介
乳头瘤病毒 (PVs) 由小型、无包膜、二十面体DNA病毒组成,可感染从鱼类到爬行动物、鸟类和脊椎动物以及人类等多种物种。绝大多数乳头瘤病毒科属的病毒对某些动物物种具有特异性,大多数毒株对各自的宿主具有高度特异性。根据ICTV (国际病毒分类委员会) 制定的一般标准,乳头瘤病毒科有两个亚科,由53个属组成,其中52个属属于第一乳头瘤病毒亚科,只有1个属属于第二乳头瘤病毒亚科。在现代分子生物学技术 (如第二代DNA测序技术) 的帮助下,目前已知的133个物种的新基因型仍在不断被发现和鉴定。
人类乳头瘤病毒 (HPV) 毒株经常引起隐性感染或形成良性乳头状瘤,通常在两年内清除。然而,越来越多的HPV株系被发现与人类主要类型的癌症有关。根据HPV信息中心描述的致癌潜力,已知的HPV株系可分为患癌风险较低的HPV类型 (低危型) 和患癌风险较高或更高的HPV类型 (高危型)。低危型HPV 6和HPV 11是良性乳头瘤的常见病因,而HPV 16和HPV 18则被归类为高危型。这些高危型HPV毒株与宫颈癌和其他肛门癌的发生有关,是全球死亡和发病的主要原因之一。关于HPV感染与头颈部鳞状细胞癌 (HNSCC)(尤其是口咽部鳞状细胞癌) 发病的因果关系的研究,促进了对潜在病理机制的了解,并确定了新的治疗靶点。
本综述从历史发展、与人类乳头瘤病毒 (HPV) 的联系以及各种RPV肿瘤细胞系的产生和使用入手,系统地概述了基于CRPV的兔动物模型。重点特别放在VX2肿瘤和以此为基础在新西兰兔身上开发的肿瘤模型上。随着在良性和恶性家兔肿瘤中发现CRPV及其对感染细胞转化的效力,正位动物模型系统被建立,近90年来一直用于回答病毒学、免疫学和肿瘤学领域的实验问题。高危型HPV毒株是正常细胞向恶性细胞转化的主要驱动力,CRPV与HPV同源性的发现极大地促进了预防性抗病毒策略的开发,拓宽了人们对病毒生命周期的总体认识,并有助于确定肿瘤发生的机制。
研究总结
CRPV感染的肿瘤细胞系的分离和肿瘤组织经供体兔肌肉传代的VX2细胞的增殖,为肿瘤生长的详细表征 (如浸润、新血管生成和转移) 奠定了实验基础。在家兔传代过程中,VX2细胞失去了毒力,但保留了CRPV基因组的遗传谱,与在HPV+HNSCC中观察到的方式相同。这样就产生了VX2细胞系,可用于体外和体内实验,以解决人类HPV相关肿瘤进展的问题。
VX2细胞能够在不同的解剖区域和组织中形成转移性肿瘤,因此可以对外科手术、介入放射技术、化疗和靶向给药策略进行测试和评估,包括对转移风险的实际评估。在免疫功能健全的兔子体内进行VX2肿瘤细胞正位移植的可行性以及VX2实体瘤的淋巴转移潜力为实验提供了决定性的优势。功能完善的免疫系统有助于开发基于免疫的肿瘤疗法,如基于细胞因子的疗法或使用检查点抑制剂的方法,并对其疗效、副作用和临床安全性进行评估。肿瘤微环境对肿瘤生长的影响以及依赖于治疗的肿瘤规避策略可以在真实条件下进行体内评估。
Viruses 期刊介绍
主编:Eric O. Freed, Center for Cancer Research, National Cancer Institute, USA
涵盖人类病毒和病毒疾病,动物病毒,植物病毒,病毒免疫、疫苗和抗病毒药物以及朊病毒等各方面研究,目前已被 SCIE (Web of Science)、MEDLINE (PubMed) 等数据库收录。
|
2024 Impact Factor
|
3.5
|
|
2024 CiteScore
|
7.7
|
|
Time to First Decision
|
17.1 Days
|
|
Acceptance to Publication
|
2.7 Days
|
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。