|
|
|
|
|
研究人员通过构建器官特异蛋白质组衰老钟来预测疾病与寿命风险 |
|
|
日常我们判断一个人是否“老了”,多半只看身份证上的岁数。但参加过二十年后同学会的人,大概都不会再怀疑:即便是同龄人,衰老的速度也并不相同。有人气色、体力和脑力与十几年前相差无几,有人却已经在心血管、代谢、肾脏等多个系统上出现了“加速衰老”的迹象。这种反映机体真实状态的生物学年龄(biological age),往往会明显偏离按年份计算的日历年龄(chronological age),而这种偏离正是解释个体间衰老相关疾病与寿命差异的关键。
围绕“生物年龄”,科学家已经提出了基于DNA甲基化、临床指标和多组学数据的多种“衰老钟”。然而,这些时钟往往只给出一个“全身年龄”,对不同器官之间如何差异性衰老涉及较少;即便有器官相关模型,也多依赖影像或常规实验室指标,难以提供深入的分子机制,更缺乏在多种族、大样本人群中的系统验证。与此同时,蛋白质组学作为介于基因与功能表型之间的中间层,既能反映器官状态,又在临床转化上具备现实基础(血浆蛋白检测已被广泛用于多种疾病诊断与监测),因此被视为构建高可解释衰老钟的理想载体。
为了解决这些关键问题,由牛津大学、哈佛大学及Broad Institute of MIT and Harvard的王云鹤博士及肖思昊博士领衔,联合牛津大学人口健康系、哈佛大学医学院和北京大学等多中心团队,于2025年11月26日在《自然—衰老》(Nature Aging)发表论文—— Organ-specific proteomic aging clocks predict disease and longevity across diverse populations。
该研究基于大规模血浆蛋白质组学构建了“全身 + 十大器官系统”的蛋白质组衰老钟体系,并首次在中国 (China Kadoorie Biobank)、英国(UK Biobank)、美国 (Nurses Health Study) 三大前瞻性大型人群队列中系统验证其在疾病预测与寿命评估中的效能,为器官定向的抗衰老干预提供了可量化框架。

从整体到器官分辨率:跨人群与种族的衰老刻度
研究团队利用 UKB 4万余名参与者的Olink血浆蛋白组数据,结合GTEx等组织表达数据库,将近3000个血浆蛋白映射至大脑、心脏、动脉、肺、肝、肾、胰腺、肌肉、免疫和肠道等10个器官/系统,筛选出器官富集蛋白,并基于LightGBM构建1个全身衰老钟和10个器官特异性衰老钟;通过“蛋白质预测年龄与实际年龄的残差”刻画各器官的age gap(衰老差值)。在性能方面,全身衰老钟在UKB测试集中的年龄相关系数约0.94,多数器官(如大脑、心血管、肾脏)也达到中高水平,并在中国CKB和美国NHS中获得良好复现,提示基于血浆蛋白的器官衰老表型具有跨人群的稳定可推广性;不同器官间 age gap 相关性普遍较低,提示心血管、大脑、免疫等系统并非同步衰老,而是形成高度异质的“多器官衰老谱”。
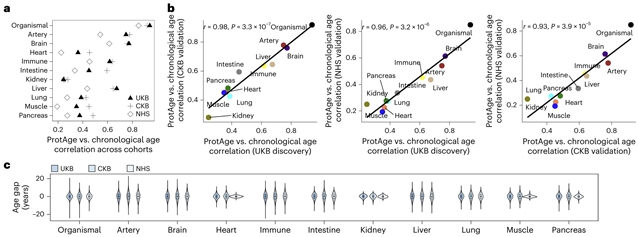
图1 器官特异蛋白衰老时钟的跨队列性能
从风险图谱到机制网络:可解释的多器官疾病预测
在此基础上,作者系统评估了各器官衰老与神经退行性疾病(阿尔茨海默病及其他痴呆)、精神疾病、心血管疾病、代谢性疾病以及全因死亡的前瞻性关联。大脑衰老钟在多种疾病和死亡预测中尤为突出:大脑 age gap不仅预测未来痴呆和认知衰退,且独立于APOE基因型等已知风险因素,且在控制时间年龄和其他器官衰老后,仍是最强的死亡风险指标之一。心血管 / 动脉、肾脏和免疫系统的加速衰老与冠心病、心衰、高血压、糖尿病风险升高有关,表明各器官蛋白质组衰老既指向自身疾病谱,也共同构成多病共存和整体健康状况的生物学基础。
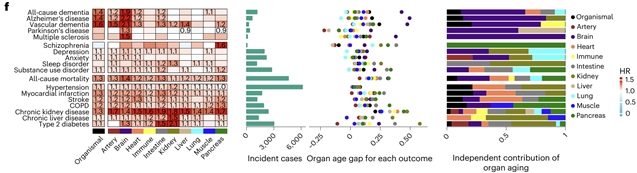
图2 器官加速衰老与多种脑及躯体慢病的前瞻性关联
在机制层面,作者整合脑组织单细胞转录组数据,发现与大脑衰老钟相关的关键蛋白在阿尔茨海默病脑组织中呈现“神经元表达下降 + 胶质细胞(星形胶质细胞、小胶质细胞)表达上升”的模式,与AD中已知的突触丢失和神经炎症高度一致;动脉衰老钟相关蛋白在脑及外周血管壁中富集,其差异表达模式提示了脑血管功能受损与全身血管老化,可通过血–脑屏障破坏和微血管退化共同推动认知衰退。
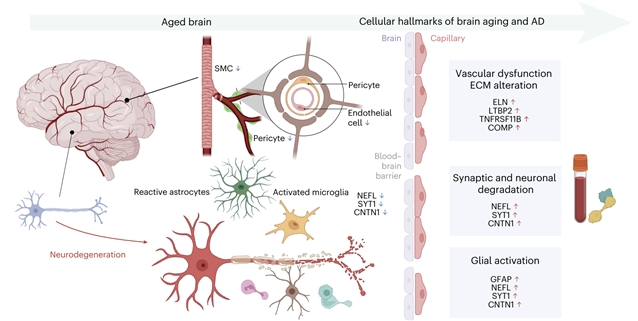
图3 动脉与大脑衰老时钟在生物衰老中,共同推动早期认知下降和神经退行性疾病发展的潜在生物学机制
在遗传风险中寻找韧性:迈向可转化的精简衰老标志物
研究还探究了APOE基因型与大脑衰老的交互:在不同APOE单倍型(包括 ε4/ε4)中,大脑age gap均能独立预测痴呆风险,在APOE4/4中效应更强,且在55–65 岁这一AD生物标志物异常的关键窗口,大脑age gap在APOE4纯合者中提前升高;作者由此提出“超年轻大脑(super-youthful brain)”概念,即在高危遗传背景下,大脑衰老明显延缓者可能表现出对痴呆的生物学“韧性”。
最后,面向临床转化,作者基于SHAP值和递归特征消除(RFE)构建了“精简蛋白面板”,全身衰老钟仅用20个蛋白即可保留约90%的预测性能,大脑衰老钟用10个蛋白仍接近完整模型,并在两个外部队列中复现良好,表明少量非空腹血浆蛋白即可实现可操作、可解释、可推广的器官衰老评估,大幅提升未来临床应用的可行性。
脑科学领域顶尖专家、牛津大学流行病学教授Cornelia van Duijn评论:“The present study highlights the key role of the brain in our life expectancy but the finding that thrills me in particular as a genetic neuro-epidemiologist is that managing your brain ageing may counteract the disadvantage based on your genetic make-up. This is a break through.”
总体来看,该研究通过三大高质量人群队列的数据整合,提出了一个兼具可解释性、可迁移性与可转化性的蛋白质组衰老框架:(1)在分子层面捕捉器官衰老特征;(2)在流行病学层面精准预测多种疾病与死亡风险;(3)在方法学层面展示了如何将复杂的多组学模型压缩为临床可行的少量指标,为未来评估生活方式干预、药物试验以及器官定向抗衰策略提供了新的量化工具。
该论文的第一作者及通讯作者王云鹤博士,长期致力于利用大规模队列与多组学数据探索脑(神经退行性疾病及精神障碍)及多种慢性躯体疾病之间的因果关联及潜在生物学机制。共同第一作者为Broad Institute的肖思昊博士。牛津大学Richard Peto流行病学教授Zhengming Chen及哈佛大学医学院教授、麻省总医院临床与转化流行病学中心主任Andrew T. Chan为论文共同资深作者。(来源:科学网)
相关论文信息:https://www.nature.com/articles/s43587-025-01016-8