|
|
|
|
|
基于DNA分子电路的外泌体microRNA原位检测 |
|
|
细胞外囊泡(EV)相关生物标志物的检测在疾病诊断中至关重要,但传统方法面临复杂操作、低特异性和RNA降解等挑战。这些问题严重影响了检测的准确性,尤其是在混杂样本中精准区分目标囊泡与非特异性囊泡。因此,开发高效、选择性识别EV生物标志物的创新策略对于实现精准诊断和临床应用至关重要。
2024年8月30日,华东师范大学裴昊研究团队在Chem期刊上发表了题为“Boosting selective fusion of protocells with DNA logic circuits for in-situ detection of exosomal microRNA”的研究成果,报道了通过DNA分子电路工程化脂质体的方法,成功实现了脂质体与目标外泌体的选择性融合,从而对外泌体microRNA进行了可靠、准确的分析,并基于miRNA检测实现了癌症的精确诊断。
细胞外囊泡(EV)相关的RNA分子(如miRNAs)是活检诊断中重要的疾病标志物。传统的分析方法(如RT-qPCR)需要经过EV分离、裂解、RNA提取、cDNA合成和PCR分析等一系列复杂耗时的步骤,容易导致RNA降解或损失,影响诊断的准确性和可靠性。近年来,基于脂质体融合的生物传感策略被提出,以解决这些问题。该策略依赖脂质体表面修饰的识别元件(如抗体、多肽和适配体)识别EV表面标记物并促进膜融合;而内置于原细胞中的DNA探针可以对目标RNA产生响应,输出检测信号,为EV相关RNA的直接检测提供了一种简便的方法。然而,囊泡表面大多缺乏独特的标记物,使得仅依赖单一标记物识别的膜融合传感策略难以有效区分目标囊泡与非特异性囊泡,易导致交叉融合,从而降低RNA检测的特异性,可能产生假阴性结果。因此,开发能够选择性融合目标EV的膜融合策略对临床中活检的精准诊断至关重要。
在这项研究中,研究团队设计并开发了一种新型的DNA分子电路工程化脂质体。该DNA电路作为分子识别程序,以外泌体表面蛋白受体作为输入,执行布尔逻辑运算(如AND、OR和NOT逻辑门),进行外泌体表面蛋白受体信号处理。通过分析这些受体标记物,DNA电路可以有效区分不同的外泌体亚型,并根据预定义的标准决定是否诱导工程化脂质体与目标外泌体选择性融合。这种选择性融合特点避免了非特异性交叉融合的风险,为目标外泌体来源的RNA提供了原位、准确的分析基础,并提高了RNA检测的置信度和可靠性。融合后,内置的步行器探针会对目标miRNA产生响应,生成放大荧光信号,实现高灵敏(检测限约为0.4 fM)、高特异性的miRNA检测。研究结果显示,采用三种DNA逻辑电路(包括AND、OR和NOT逻辑电路)可高效促进脂质体和外泌体的选择性融合。基于DNA电路工程化脂质体的检测平台能够直接检测细胞培养基和血浆中的肿瘤来源外泌体miRNA,并在14个临床样品分析中显示出对胰腺癌诊断的准确性,展示了其在癌症诊断中的应用潜力。
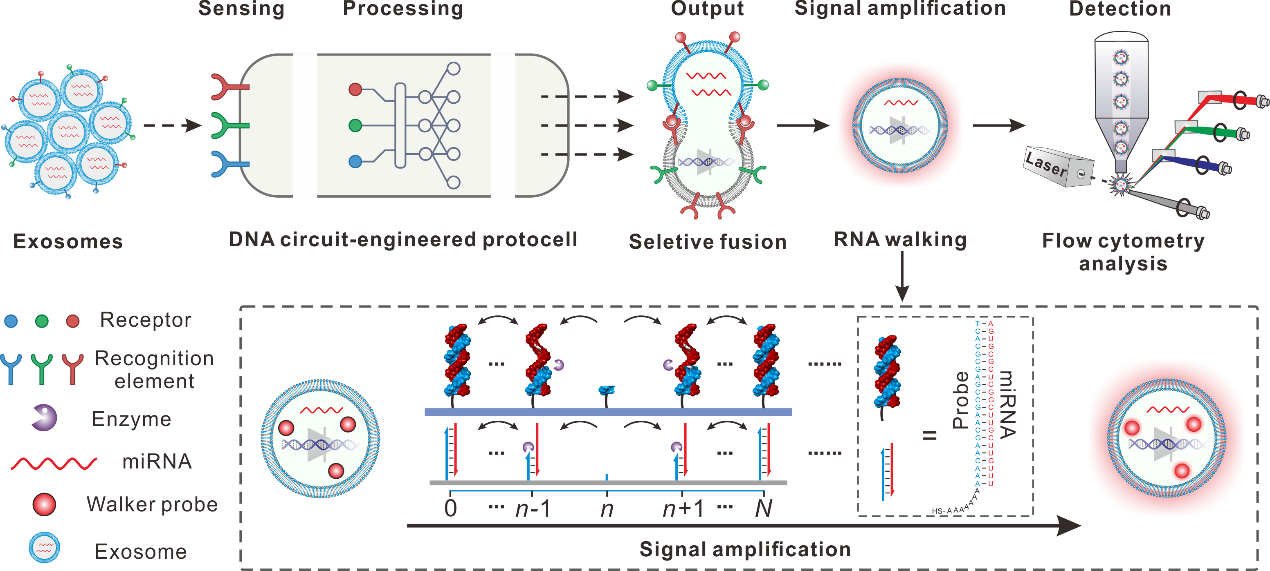
图1:基于DNA分子电路促使脂质体与目标外泌体选择性融合实现外泌体miRNA精准检测的示意图。
这项研究展示了DNA分子电路在增强脂质体选择性融合中的潜力,为基于miRNA的液体活检在癌症临床诊断中的应用提供了一种快速、准确且可靠的新技术,同时也为外泌体生物标志物的检测开辟了新的思路。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2024.07.037