中山大学肿瘤防治中心主任医师牟永告/陈丽昆团队与合作者,通过全球最大规模的肺癌原发灶和脑转移配对临床肿瘤组织样本多组学分析,系统揭示了肺癌脑转移独特的分子机制与微环境特征,为精准治疗带来新思路。相关成果近日发表于 《基因组医学》(Genome Medicine)。
论文第一作者、中山大学肿瘤防治中心神经外科副主任医师段昊表示,作为肺癌患者中常见的高致死性并发症,肺癌脑转移的现有治疗手段效果有限,亟需创新疗法。
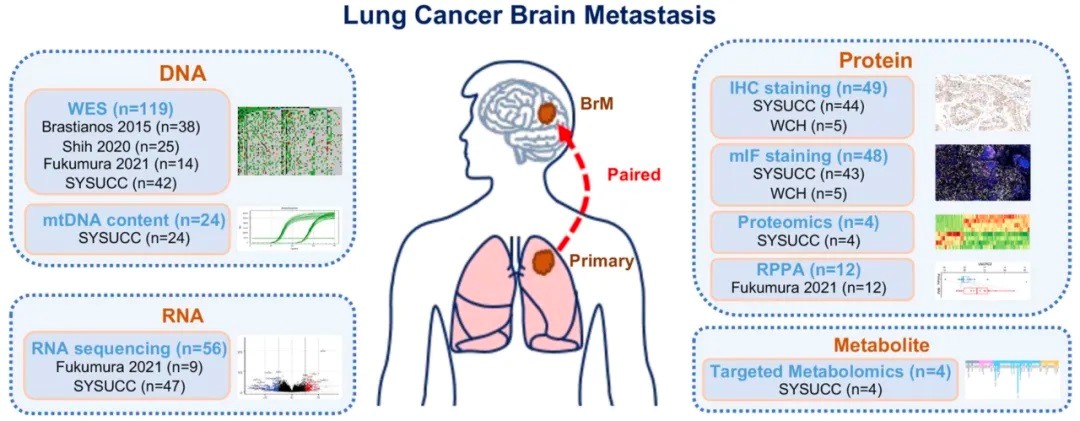
研究示意图。研究团队供图
?
据介绍,牟永告/陈丽昆团队联合香港大学教授张高团队、四川大学华西医院教授刘伦旭团队等多家医疗科研机构,通过对154例患者的肺癌原发灶和脑转移的基因组、转录组、蛋白质组和代谢组数据进行整合分析,全面揭示了这些病灶的突变特征及分子机制。分析显示,部分基因突变(如TP53和EGFR)在原发性肺癌和脑转移病灶中高度一致,但脑转移病灶表现出显著更高的肿瘤内异质性,这种特征可能有助于癌细胞在脑中的适应性生存和耐药性。
研究进一步揭示了肺癌脑转移的代谢与免疫微环境特征,发现脑转移病灶的线粒体代谢尤其是氧化磷酸化通路显著活跃,而肿瘤免疫微环境则显示出明显的抑制特性。这种独特的“代谢脆弱性”让研究团队找到了潜在的治疗突破口。实验验证表明,使用靶向氧化磷酸化的药物能够有效诱导脑转移病灶中的肿瘤细胞凋亡并显著抑制其增殖,展示了对这一特殊代谢途径进行治疗干预的潜力。
基于上述发现,研究团队进一步探索了氧化磷酸化抑制剂与抗PD-1免疫疗法联合治疗的效果。结果表明,这一创新的组合疗法显著延长了肺癌脑转移小鼠模型的生存期,展现了靶向代谢与免疫微环境双管齐下的疗效优势。这种个体化的联合治疗策略不仅改善了治疗效果,更为临床试验开辟了新思路。
“希望针对氧化磷酸化的治疗策略能在临床上进一步验证,造福更多患者。”论文共同通讯作者牟永告表示,该研究让我们更深入地理解了肺癌脑转移的代谢与免疫微环境特征,也为未来的精准治疗提供了参考。(来源:中国科学报 朱汉斌 赵现廷)
相关论文信息:https://doi.org/10.1186/s13073-024-01410-8