导读
无透镜片上显微成像作为一种新型的高通量计算光学显微成像技术,突破了传统光学显微镜中空间带宽积的限制,能够在传感器固有的大视场下实现高分辨率成像。然而,目前报道的无透镜显微技术多局限于薄样品的二维成像。如何在全视场实现高分辨率的三维成像仍然是无透镜片上显微技术面临的一个关键挑战。
近日,南京理工大学陈钱、左超教授研究团队提出了一种基于波长扫描傅里叶叠层衍射层析技术(wavelength-scanning Fourier ptychographic diffraction tomography,简称wsFPDT)的新型无透镜片上三维显微成像技术通过波长扫描的照明调控方式实现三维散射势的频谱填充。与基于多角度照明的无透镜三维成像方法相比,该技术不会引入图像移位、畸变等问题,实现了全视场分辨准均匀、无标记、高通量的衍射层析成像。该工作以“Lens-free on-chip 3D microscopy based on wavelength-scanning Fourier ptychographic diffraction tomography”为题发表在Light: Science & Applications。
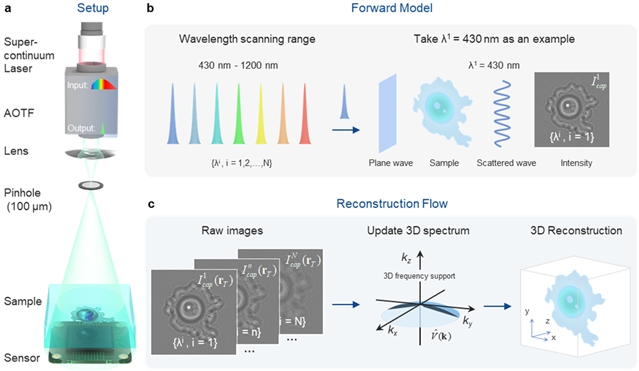
图1:基于wsFPDT无透镜片上三维成像的基本思想。(a) 光学实验装置示意图。(b) 实验过程示意图。(c) wsFDPT重建原理。
光学显微镜作为生命科学、医学和材料科学等领域的核心观测工具,其性能在很大程度上取决于其核心部件——物镜,其决定了显微成像的两个关键参数:分辨率和成像视场。然而受拉格朗日不变量等因素的制约,在传统显微镜中这两者往往存在一种权衡关系,即低倍率物镜虽然能提供宽广的视场,但会牺牲成像的分辨率;而高倍率物镜虽然能提供较高的成像分辨率,却会显著缩小视场范围。随着生物医学领域的基础研究和前沿技术的不断进步,对能够实现跨尺度、高通量显微成像的需求日益增长。然而,传统显微镜的空间带宽积通常局限于百万至千万像素量级,普遍无法兼顾分辨率和视场的双重要求。因此,能够同时提供高分辨率和大视场成像的新型光学显微技术,已成为该领域的重点研究方向之一。
近年来,计算光学显微成像技术,如合成孔径全息术[1]、傅里叶叠层显微术[2]和无透镜片上显微术[3]等飞速发展,不断推动着高分辨率、大视场显微成像技术的理论探索与技术创新。其中,无透镜片上显微成像技术无需任何透镜或其他中间光学组件,将样品直接放置在传感器表面,通过对采集的衍射图样进行数字重聚焦和相位反演获得样品的定量相位信息。相比传统显微镜,无透镜片上显微成像技术的最大优势在于其成像视场可以达到图像传感器感光面的大小,但是其成像分辨率又受限于传感器像素的离散采样。为了提升成像分辨率,无透镜显微成像可以与多离焦距离扫描[4,5]、平行板微扫描[6]、波长扫描[7,8]等实验手段相结合,突破传感器像素尺寸所对应的采样物理限制,获得极大的空间带宽积。此外,该技术无需任何透镜的设计可有效降低系统成本、简化设备结构,且有效规避成像视场与成像分辨率之间的矛盾,在细胞生物学、病理筛查、药物筛选等领域展现出巨大的应用潜力。
然而,许多生物细胞和组织的厚度不能忽略,在成像过程中简单近似成二维透射率函数无法表征其内部三维结构。相比于二维定量相位成像技术,光学衍射层析成像技术[9]更适合厚样品折射率重建,揭示生物细胞和组织的三维结构特征。目前,尝试解决无透镜片上层析成像问题的工作很少。最早在2011年Isikman等[10]提出了一种基于机械臂光源扫描的无透镜片上三维成像方法,记录不同照明角度下的衍射图样,利用滤波反投影算法进行三维重建。由于忽略衍射信息,该方法仅适用于吸收型样品。另一个典型工作是2015年南京理工大学陈钱、左超教授研究团队[11]使用彩色LED阵列构建了一个小型化的无透镜片上三维成像系统,在衍射层析成像理论框架下考虑了样品的衍射效应,通过多波长相位恢复获得每个照明角度下的复振幅,再基于傅里叶衍射层析定理合成三维频谱,实现了对样品的三维折射率的定量重建。以上述工作为代表的现有的片上层析成像技术通常采用基于机械光束扫描或固定多光源阵列的多角度照明方案。然而,由于在无透镜系统中样品只能在离焦平面上成像,倾斜照明将导致衍射图样的移位和畸变,且大角度照明下,图像有可能会“飞出”传感器的视场范围造成数据丢失。这些移位的原始数据集不仅使重建变得更加复杂,而且导致图像传感器边缘的成像分辨率相较于中心区域显著降低。因此,如何获得全视场像素超分辨的无透镜片上层析成像仍然是当前面临的一大挑战。
波长扫描傅里叶叠层衍射层析成像
傅里叶叠层显微成像技术是一种新型的计算光学显微成像方法,最早于2013年由郑国安教授[2]等人提出。该技术将合成孔径和相位恢复融合到同一框架中,解决了传统显微镜中分辨率和视场的矛盾,同时实现大视场高分辨率定量相位成像。2016年,Horstmeyer等[12]将光学衍射层析技术与傅里叶叠层成像技术相结合,提出了傅里叶叠层层析技术,将傅里叶叠层成像由一种二维定量相位成像技术发展成一种三维光学衍射层析技术。2020年,南京理工大学陈钱、左超教授研究团队[13]在一阶Born与Rytov两种近似下完整推导出了明场与暗场图像三维频谱更新模型,并将大角度暗场照明融入其中,实现了真正意义上的傅里叶叠层衍射层析,并大幅提升三维层析成像的横向和轴向分辨率。2023年,该研究团队[14]进一步通过耦合透射角度扫描和反射波长扫描两种照明模式,使得物函数频谱覆盖支持域突破了单物镜数值孔径的限制,轴向分辨率提升了3倍,实现了准各向同性高分辨率三维衍射层析成像。在上述工作的基础上,本研究工作首次将波长扫描傅里叶叠层衍射层析(wsFPDT)技术拓展到无透镜显微成像平台,实现全视场像素超分辨的三维衍射层析成像。
与传统的基于多角度照明的无透镜三维成像方法不同,wsFPDT方法仅使用波长扫描光源垂直照射样品,记录不同波长下的低分辨率衍射图样。然后基于傅里叶叠层重建算法对欠采样的衍射图样重复迭代约束直至收敛,再进行非负约束和全变分正则化相结合的混合约束处理,获得样品像素超分辨的三维折射率分布(图2)。由于成像过程不引入任何机械位移,波长扫描方案解决了传统多角度照明方案所引起的图像移位、畸变和亚像素配准等挑战,在传感器全视场范围内实现了准均匀的成像分辨率。
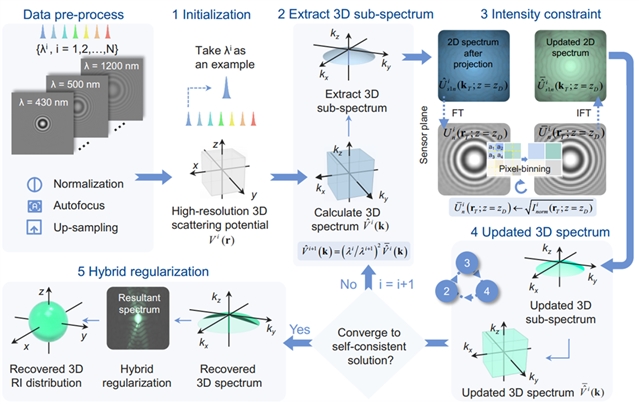
图2:wsFPDT方法重构算法流程图。
非干涉光学衍射层析
传统的光学衍射层析方法依靠干涉和全息相位测量技术来获得散射场的复振幅。然而,基于干涉测量的实验方案往往依赖复杂的系统,需要仔细校准,且容易受到相干噪声以及环境扰动的影响。而且无透镜片上显微成像平台空间狭小,难以容纳分离的参考光路,很难实现干涉测量。wsFPDT技术不依赖于干涉测量,在无透镜系统上使用波长扫描照明成功实现三维层析成像。利用wsFPDT可以同时实现相位恢复、像素超分辨重建和合成孔径,获得高通量三维成像,为细胞生物学研究和药物筛选提供了一种新的工具。
高分辨率大视场三维成像
该研究团队构建了无透镜片上三维衍射层析成像的显微硬件系统(图1a),包含单色板级CMOS传感器(1.67 μm,3872×2764)和超连续激光器与声光滤波器组成的波长扫描光源。综合考虑光源输出和传感器响应范围,用于实验的最大扫描范围为430-1200 nm。团队自主开发C++控制软件实现声光滤波器与传感器同步触发,可在6秒内完成图像采集。
为了验证wsFPDT技术在全视场范围内实现高通量三维成像的能力,图3a展示了针对倾斜USAF分辨率靶标的成像结果。成像结果的横向与轴向剖线表明:wsFPDT获得了775 nm横向分辨率和5.43 μm轴向分辨率,有效超越了CMOS传感器像素尺寸(1.67 μm)采样限制的2.15倍。进一步地,将选定的USAF靶标图案分别水平放置在传感器的中心和边缘位置(图3b-c)并重复实验,可以得到近乎相同的成像结果,这表明了wsFPDT技术能够提供全视场内准均匀的成像分辨率。此外在此实验中,倾斜的USAF分辨率靶标被悬空放置,致使其离焦距离相较紧贴传感器放置时要远离200 μm以上,这说明wsFPDT方法在不牺牲横向成像分辨率的情况下,能够实现超过200 µm的有效成像深度,该成像深度要比传统的基于透镜的光学衍射层析技术高出5到10倍左右。这使得wsFPDT技术在大尺寸生物样品三维成像中展现了巨大的应用潜力。图4展示了wsFPDT方法对两种硅藻进行三维重建的结果,从中可以清晰看到硅藻壳的三维骨架结构及其内部复杂的细节信息,该实验进一步证明了wsFPDT方法在处理较厚且具有复杂轴向结构样品的三维层析能力。
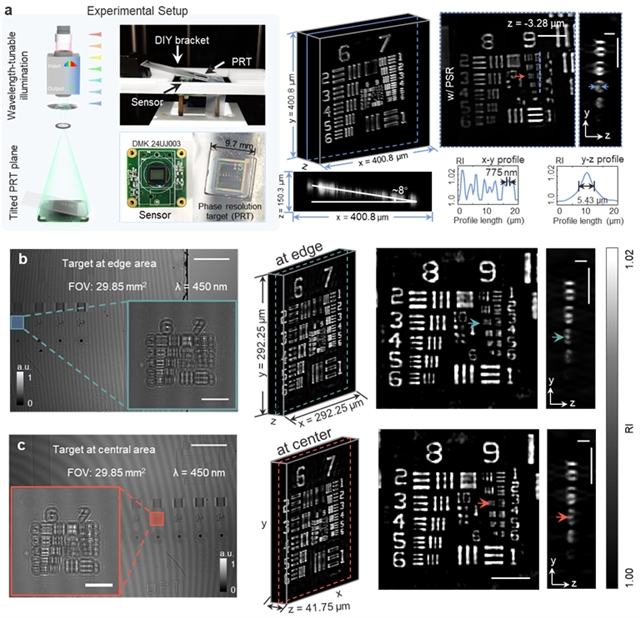
图3:相位分辨率靶标的实验结果。(a) 倾斜放置的分辨率靶标的实验装置设计和重建结果。(b-c) 选定的靶标放置在传感器不同位置的成像结果对比。
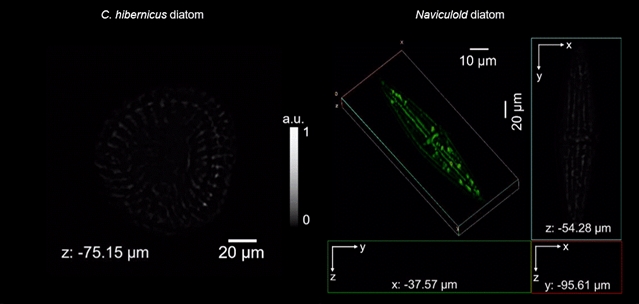
图4:C. hibernicus硅藻(左)和Naviculold硅藻(右)的实验结果。
视频1展示了wsFPDT对无标记小鼠单核巨噬细胞高通量三维成像的结果。wsFPDT可以对全视场(29.85 mm2)内所有细胞同时实现定量三维折射率的重建,重建结果包含约18.3亿有效体素,视场范围覆盖约32,000个巨噬细胞。基于所获得的三维折射率分布,可实现对每个细胞的形态学参数(如体积、面积和球形度等)精确的定量分析。实验结果不仅验证了wsFPDT针对大量未染色细胞集群的高通量三维成像方面的能力,还展示了其在单细胞层面进行定量分析的潜力,将为研究细胞的结构特征及其对内部和外部刺激(如渗透压和药物治疗)的反应提供重要的统计数据支持。该方法有望为大规模细胞分析、高内涵精准筛选等方面提供重要的影像学支撑,并在高通量药物研发和无标记病理分析等领域具有重要的应用前景。
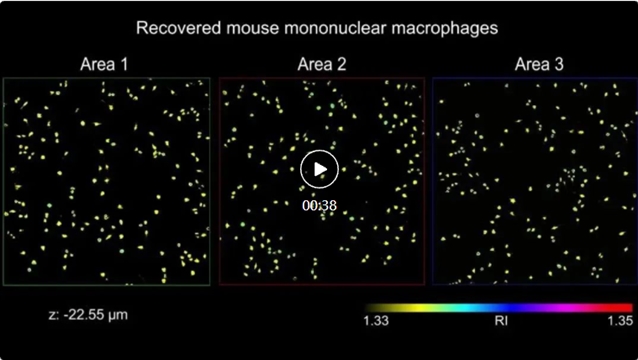
视频1:小鼠单核巨噬细胞的全视场三维成像。
本研究首次将波长扫描傅里叶叠层衍射层析(wsFPDT)拓展到无透镜片上显微成像平台,通过采用波长扫描照明方案,成功实现了无标记、全视场、准均匀像素超分辨的无透镜片上三维显微层析成像。同时,其片上无透镜的光学系统结构赋予了wsFPDT技术小型化和集成化的潜力,为便携式高通量三维显微成像系统的发展奠定了基础。由于wsFPDT仅采用了单角度透射照明,散射势频谱覆盖范围仍较为有限,今后研究团队将尝试将深度学习融入至wsFPDT重建框架中,以提升三维折射率测量的精度。同时,研究团队也将致力于进一步优化光学系统的关键参数(如采用更小像素尺寸的传感器,并与多角度照明相结合等)以及改进wsFPDT重建算法以提升成像的分辨率、成像深度和成像速度,其有望为生物医学领域众多需要高通量、无标记、三维显微成像的应用场景开辟新的可能性。(来源:中国光学微信公众号)
相关论文信息:https://doi.org/10.1038/s41377-024-01568-1
参考文献
1. Hillman, T. R., Gutzler, T., Alexandrov, S. A. & Sampson, D. D. High-resolution, wide-field object reconstruction with synthetic aperture Fourier holographic optical microscopy. Opt. Express 17, 7873 (2009).
2. Zheng, G., Horstmeyer, R. & Yang, C. Wide-field, high-resolution Fourier ptychographic microscopy. Nature Photon 7, 739–745 (2013).
3. Gorocs, Z. & Ozcan, A. On-Chip Biomedical Imaging. IEEE Rev. Biomed. Eng. 6, 29–46 (2013).
4. Greenbaum, A. & Ozcan, A. Maskless imaging of dense samples using pixel super-resolution based multi-height lensfree on-chip microscopy. Opt. Express 20, 3129 (2012).
5. Zhang, J., Sun, J., Chen, Q., Li, J. & Zuo, C. Adaptive pixel-super-resolved lensfree in-line digital holography for wide-field on-chip microscopy. Sci Rep 7, 11777 (2017).
6. Zhang, J., Chen, Q., Li, J., Sun, J. & Zuo, C. Lensfree dynamic super-resolved phase imaging based on active micro-scanning. Opt. Lett. 43, 3714 (2018).
7. Luo, W., Zhang, Y., Feizi, A., Göröcs, Z. & Ozcan, A. Pixel super-resolution using wavelength scanning. Light Sci Appl 5, e16060–e16060 (2016).
8. Wu, X. et al. Wavelength-scanning lensfree on-chip microscopy for wide-field pixel-super-resolved quantitative phase imaging. Opt. Lett. 46, 2023 (2021).
9. Wolf, E. Three-dimensional structure determination of semi-transparent objects from holographic data. Optics communications 1, 153–156 (1969).
10. Isikman, S. O. et al. Lens-free optical tomographic microscope with a large imaging volume on a chip. Proceedings of the National Academy of Sciences 108, 7296–7301 (2011).
11. Zuo, C., Sun, J., Zhang, J., Hu, Y. & Chen, Q. Lensless phase microscopy and diffraction tomography with multi-angle and multi-wavelength illuminations using a LED matrix. Opt. Express 23, 14314 (2015).
12. Horstmeyer, R., Chung, J., Ou, X., Zheng, G. & Yang, C. Diffraction tomography with Fourier ptychography. Optica 3, 827 (2016).
13. Zuo, C., Sun, J., Li, J., Asundi, A. & Chen, Q. Wide-field high-resolution 3D microscopy with Fourier ptychographic diffraction tomography. Optics and Lasers in Engineering 128, 106003 (2020).
14. Zhou, N. et al. Quasi-Isotropic High-Resolution Fourier Ptychographic Diffraction Tomography with Opposite Illuminations. ACS Photonics 10, 2461–2466 (2023).
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。