|
|
|
|
|
催化氢化反应中氨基阴离子金属氢活性中间体的结构与性质 |
|
|
2022年9月12号,清华大学刘强课题组和郑州大学蓝宇课题组合作在Nature Chemistry上发表了一篇题为“Structure, reactivity and catalytic properties of manganese-hydride amidate complexes”的研究成果。
该研究首次分离获得了催化氢化反应中的氨基阴离子金属氢活性中间体(“M'N-MH”),并对其反应性质和催化性能进行了深入研究,发现该类活性中间体相比于金属配体协同参与催化体系中经典的氨基金属氢中间体(“HN-MH”)具有更高的催化效率。论文通讯作者是刘强、蓝宇;第一作者是王玉杰、刘士晗。
催化氢化反应在有机合成和化工生产中占有重要的地位,是许多基本有机化学品、精细化工产品以及药物分子合成的关键步骤。传统的羰基氢化反应通常通过內层(inner-sphere)反应机制发生(图1b),由于存在氧原子与金属中心的配位作用,反应效率不高;此外,羰基与烯烃底物的竞争配位导致C=O/C=C氢化选择性难以控制。自从诺贝尔奖获得者Noyori教授于1995年报道了具有N-H结构、金属配体协同参与效应的钌双膦双胺催化体系以来,极性不饱和底物氢化反应的催化效率和选择性得到了显著提升。其中最具代表性的例子包括我国科学家周其林院士发展的含有N-H结构的手性螺环铱催化剂,在苯乙酮的不对称氢化反应中达到了455万的催化剂转化数(TON),是目前为止均相不对称催化反应的最高记录。此类金属配体协同参与催化体系的关键活性中间体为氨基金属氢物种(“HN-MH”),N-H基团在反应过程中通过氢键作用活化底物,通过外层(outer-sphere)反应机制可以有效促进负氢转移过程的发生(图1c, X=H)。
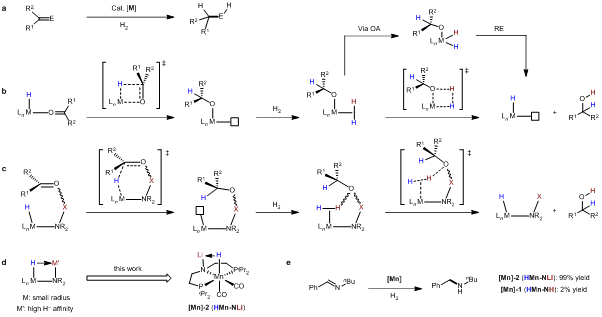
图1:催化氢化及其反应机理
后续机理研究推测在上述催化氢化反应中,过量碱M’OR(M’代表碱金属)的存在可能促使N-H基团发生去质子化生成N-M’结构,所得到的氨基阴离子金属氢配合物(“M’N-MH”)是该类反应的关键催化活性中间体(图1c, X=M’)。然而,目前关于氨基阴离子金属氢中间体的形成和反应性质研究仅局限于理论计算,这是由于具有催化氢化活性的氨基阴离子金属氢中间体的分离表征极为困难,从而制约了新颖、高效金属配体协同参与催化体系的设计与发展。刘强和蓝宇研究团队设想选取具有较小原子半径的3d丰产金属锰作为中心金属,可以拉近负氢与碱金属离子之间的距离,有望利用具有较高负氢亲和性碱金属离子的辅助配位作用稳定氨基阴离子金属氢中间体(图1d)。基于上述设计思路,他们成功分离获得了基于钳形配体骨架的氨基阴离子锰氢中间体(“LiN-MnH”),并对其进行了全面的结构表征以及反应性质和催化性能研究。
氨基阴离子金属氢活性中间体的分离
叔丁醇钾是催化氢化反应中的常用碱,作者首先研究了“HN-MnH”配合物与叔丁醇钾的当量反应。研究结果发现叔丁醇钾可以促进“HN-MnH”中间体的快速异构化,并没有通过原位核磁监测到相应“KN-MnH”活性中间体(图2a、b)。进一步研究发现,选取碱性更强的烷基锂试剂LiCH2SiMe3与“HN-MnH”配合物进行反应,核磁上可以观察到一组新的负氢信号和膦信号(图2b),但是所生成的金属负氢物种在脱除溶剂过程中不稳定,会发生部分分解。为了解决这一难题,作者在氢气氛围下进行该反应,成功分离了氨基阴离子金属氢“LiN-MnH”活性中间体,并得到了其单晶结构(图2c、d)。晶体结构中Li与H的距离仅为1.81Å,N-Li-H的键角为82.5°(图2e),表明Li与H之间存在成键作用,对于稳定该氨基阴离子金属氢活性中间体起到了重要作用。

图2:氨基阴离子金属氢活性中间体的合成、分离与表征
氨基阴离子金属氢活性中间体的反应性研究
作者选取二芳基酮为模板底物,通过紫外可见光谱进行反应动力学研究,对比了“LiN-MnH”和相应“HN-MnH”配合物的反应活性差异。结果表明,在当量反应中二芳基酮与“LiN-MnH”中间体的负氢转移速率(0.22 M-1s-1)是与“HN-MnH”配合物反应速率(0.0093 M-1s-1)的24倍(图3),通过Eyring方程可计算得到“LiN-MnH”和相应“HN-MnH”配合物与底物1a反应的活化能差值为1.84 kcal/mol。
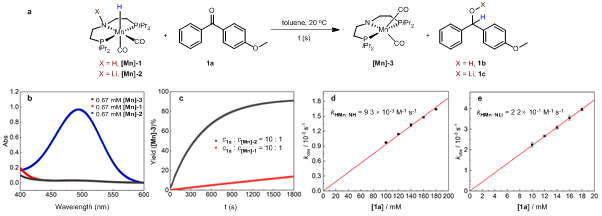
图3:反应动力学
为了进一步理解“LiN-MnH”和“HN-MnH”配合物反应性差异的内在原因,作者通过DFT计算对上述当量反应过程的反应势能面进行了研究。对于“HN-MnH”配合物,羰基底物与N-H基团配位吸热2.3 kcal/mol,随后发生分步的负氢和质子转移,总活化能为20.2 kcal/mol。与之不同的是,羰基底物与“LiN-MnH”配合物的N-Li基团配位是一个显著放热的过程(放热6.1 kcal/mol),总的反应能垒为18.6 kcal/mol(图4)。理论计算得到的反应活化能差值(1.6 kcal/mol)与动力学实验测得的结果(1.84 kcal/mol)能很好地吻合。
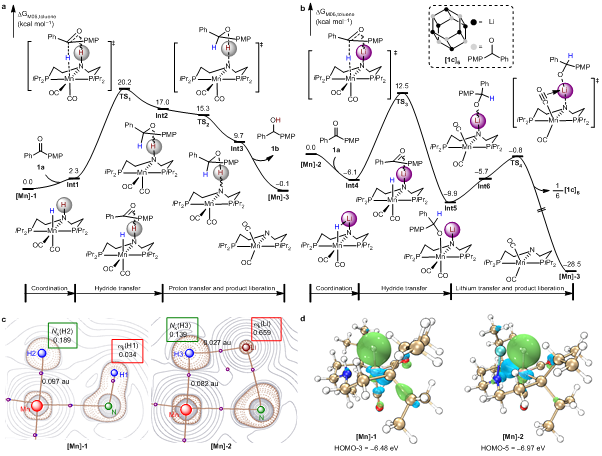
图4:DFT研究
通过电子密度拉普拉斯函数分析发现,“LiN-MnH”配合物中Li离子的亲电指数是0.659eV,显著高于“HN-MnH”配合物中质子的亲电指数0.034eV(图4c)。以上研究结果表明,“LiN-MnH”配合物的高反应活性是由于N-Li结构中的Li离子作为路易斯酸亲电活化底物的能力明显优于N-H结构中的质子,从而有效降低了负氢转移反应的活化能。
氨基阴离子金属氢活性中间体的催化性能研究
尽管“LiN-MnH”相比于“HN-MnH”配合物在与羰基底物的当量反应中具有更高的反应活性,二者在酮类底物的催化氢化中却展现出几乎一样的催化效率(图5a),这是由于“LiN-MnH”配合物与酮类底物很容易发生氢转移反应生成氨基金属中间体和烷氧基锂。由于后者碱性不足无法完成“LiN-MnH”活性中间体的再生,从而发生以“HN-MnH”为实际催化活性物种的反应过程(图5b)。因此,保持“LiN-MnH”活性中间体在反应中的稳定性是实现高效催化过程的关键所在。作者设想N-烷基醛亚胺是合适的反应底物,因其氢化产物二烷基胺与“LiN-MnH”可以构建一个酸碱平衡反应过程,可以保证在催化体系中始终存在一定量的“LiN-MnH”活性物种,从而可以在催化反应中发挥出“LiN-MnH”具有更高负氢转移反应活性的优势(图5c,d)。
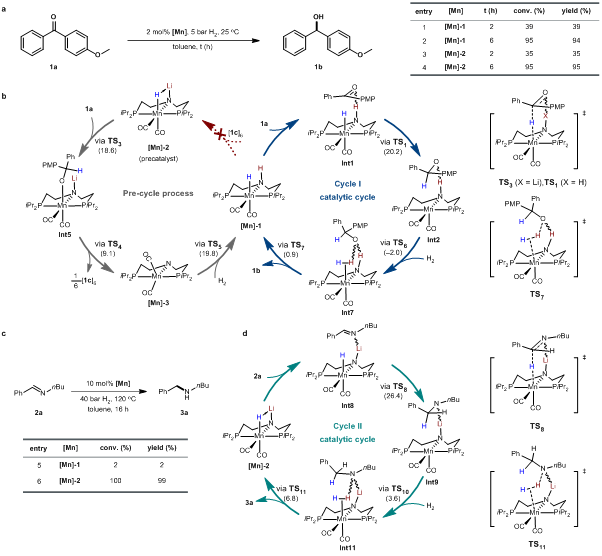
图5:催化性能研究
“LiN-MnH”配合物作为活性催化剂确实在各类N-烷基醛亚胺的氢化反应中均展现出显著优于“HN-MnH”配合物的催化活性(图6b)。然而,该配合物在N-烷基酮亚胺的氢化反应中的催化活性依然不理想(图6e)。通过进一步结构优化,作者发现通过氨基金属配合物与烷基铝氢反应可以便捷地制备“AlN-MnH”络合物(图6c、d),使用路易斯酸性更强的三价Al离子作为桥联金属所制备的氨基阴离子锰氢活性中间体表现出更为优异的催化反应性能(图6b、e)。

图6:“AlN-MnH”合成与催化氢化底物适用性
以上研究结果为双金属协同活化负氢转移反应机制提供了坚实的实验证据,并验证了这一新反应模式相比于经典的氢键协同负氢转移模式具有更高的反应效率,对金属配体协同参与催化体系的理性设计与演化具有重要的借鉴意义。
以上研究工作实验部分由清华大学刘强团队完成,理论计算部分由郑州大学蓝宇团队完成。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-022-01036-6