|
|
|
|
|
Life:固有无序蛋白精选文章合集 | MDPI 编辑荐读 |
|
|
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650049260&idx=2&sn=
549870d0e9e705b04ca3487ad43deae9&chksm=f1d93028c6aeb93e3a8a31e7ba9405cfd
cdd63a7d8c21fb7ca424b9f7269c2f921bc570832fa&token=1910072809&lang=zh_CN#rd
期刊链接:https://www.mdpi.com/journal/life
真核生物和原核生物基因组中编码的相当一部分蛋白质具有部分或全部结构无序的特点。其中,无序区域可以调节蛋白质分子的生物活性,如产生分子复杂性的倾向,包括对相分离的调节。有越来越多的研究证实,固有无序蛋白质参与基本的生物过程,包括细胞信号传递、蛋白质翻译和转录调控,并在功能作用和病理机制中至关重要。
目前,固有无序蛋白的功能作用吸引了越来越多研究者的关注,但了解其生物活性的基本结构和机制原理仍然是一个关键的研究挑战。本期推文为您介绍发表于期刊Life上,并在此领域受到广泛关注的文章,希望能够为相关领域的研究学者带来思考与启发。
01.Interaction of Oxidative Stress and Misfolded Proteins in the Mechanism of Neurodegeneration
氧化应激和错误折叠的蛋白质在神经变性机制中的相互作用
Andrey Y. Abramov et al.
https://doi.org/10.3390/life10070101
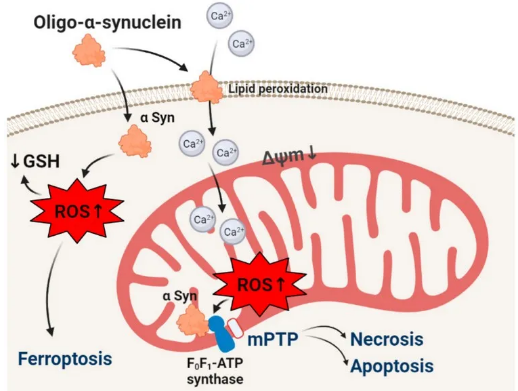
错误折叠的蛋白质β-淀粉样蛋白、tau、huntingtin和α-synuclein的聚集是大部分神经退行性疾病病理学基础中最重要的步骤之一,其中两个最常见的疾病是阿尔茨海默氏症和帕金森氏症。这些蛋白质的活性和毒性取决于聚合体的阶段和形式。研究表明,自由基 (包括导致氧化应激的活性氧) 的过度产生参与了大多数神经退行性疾病的病理机制;活性氧和错误折叠的蛋白质在大脑中都发挥着生理作用,只有氧化还原状态和蛋白质的聚集才会导致病变。本综述总结了错误折叠的蛋白质在激活神经元和胶质细胞中活性氧产生中的作用,本文主要讨论了自由基是否能影响关键毒性中间体的结构变化,并介绍了氧化应激和低聚物可能导致神经元死亡可能的发病机制。
02.Amyloidogenic Intrinsically Disordered Proteins: New Insights into Their Self-Assembly and Their Interaction with Membranes
淀粉样变性的固有无序蛋白:对其自组装及其与膜的相互作用的新见解
Federica Scollo et al.
https://doi.org/10.3390/life10080144
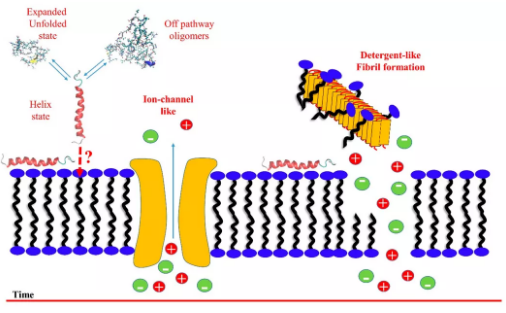
Aβ、IAPP、α-synuclein和朊病毒蛋白都属于致淀粉样变的内在无序蛋白家族。针对他们的分子毒理机制存在很多假说,其中最具代表性的是蛋白质和细胞膜的相互作用。因此,了解分子层面的相互作用机制对于揭示驱动这一现象的原因至关重要。本篇综述,作者从历史角度和未来的角度分别阐述这个话题,并介绍了两个新的见解:化学平衡以及低聚物的对称性破坏。
03.Optimization of Molecular Dynamics Simulations of c-MYC1-88—An Intrinsically Disordered System
c-MYC1-88的分子动力学模拟的优化——一个本质上无序的系统
Sandra S. Sullivan et al.
https://doi.org/10.3390/life10070109
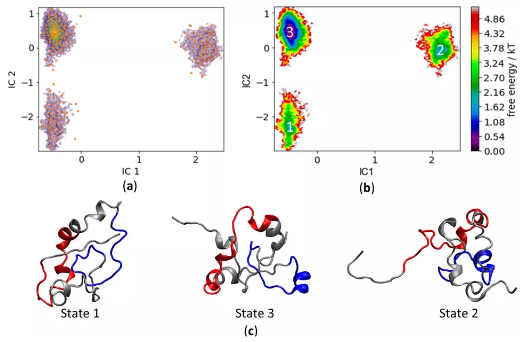
许多参与关键细胞调控事件的蛋白质含有大量的内在无序区域,不容易进行常规的结构/功能剖析。肿瘤蛋白c-MYC在控制细胞增殖和凋亡方面起着关键作用,其70%以上的主序列是无序的,因而阐明二级和三级结构构象范围的计算方法为研究此类蛋白质提供了唯一可实现的机会。本文作者研究并描述了对c-MYC的N端88个氨基酸的分子动力学模拟中所采用力场和水模型的几次测试结果,将模拟数据与核磁共振获得的实验性二级结构分配进行比较,确定一种特殊的隐含溶解方法是高度一致的。研究结果提供了c-MYC1-88结构动力学的新见解,是一种有助于指导未来实验的新方法。
04.The Conformational Plasticity Vista of PDZ Domains
PDZ结构域的构象可塑性展望
Javier Murciano-Calles
https://doi.org/10.3390/life10080123
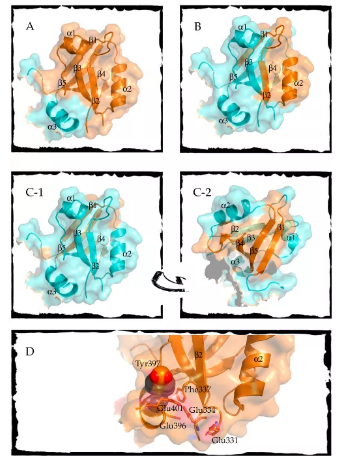
PDZ结构域 (PSD95-Discs large-ZO1) 是存在于生物体内的一个广泛存在的模块结构域,它的一个普遍功能是连接支架和适配器蛋白和其他信号通路。因此,仅从结构-活性关系的静态角度来解释该功能是不够的,应从蛋白质折叠中动态和构象方面来解释。这篇综述重点总结了PDZ折叠领域的大量研究以及蛋白质折叠景观的相关知识,主要包括错误折叠,变构,以及翻译后修饰如何通过构象变化改变功能和结合方式。总之,PDZ结构域的连接功能可能来自PDZ折叠的内在可塑性。
05.Functional Mammalian Amyloids and Amyloid-Like Proteins
哺乳动物的功能性淀粉样和类淀粉样蛋白
Maria S. Rubel et al.
https://doi.org/10.3390/life10090156
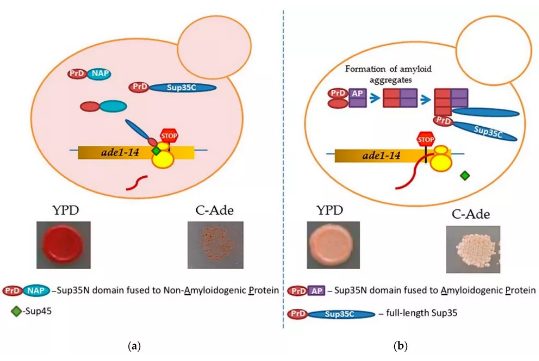
淀粉样蛋白是高度有序的纤维状交叉β蛋白聚集体,因其与各种无法治愈的人类/动物疾病相关而臭名昭著,如阿尔茨海默病、帕金森病、2型糖尿病和朊病毒病。但近期研究发现,许多淀粉样蛋白 (功能性淀粉样蛋白) 参与了对生物体有益的各种重要的生物功能,如长期记忆、肽类激素的储存和动物体内黑色素聚合的支架、底物附着以及细菌和真菌的生物膜形成等,其在生物和病理过程中发挥着重要作用。本综述主要关注哺乳动物的功能性淀粉样蛋白,并总结了用于识别新的潜在淀粉样蛋白和结构域的方法。
文案审校

孙有良 博士
清华大学
Life期刊介绍
期刊主要关注生命科学主题相关的最新研究成果。领域涵盖天体生物学、生命起源、蛋白质和蛋白质组学、细胞生物学和组织工程、遗传学和基因组学、合成生物学和系统生物学、微生物学与工程学、植物学、动物学、生理学和病理学等各生命科学领域。目前,期刊已被Science Citation Index Expanded (SCIE)、PubMed、Scopus等数据库收录。
2020 Impact Factor:3.817
Time to First Decision:14.6 Days
Time to Publication:34 Days


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。