|
|
|
|
|
钴催化实现烯烃与N-氟代双苯磺酰亚胺的自由基氢胺化反应 |
|
|
2021年9月25日,东北师范大学张前教授团队在Angew. Chem. Int. Ed.上发表了一篇题为“Cobalt-Catalyzed Radical Hydroamination of Alkenes with N-fluorobenzenesulfonimides”的新研究。
课题组在前期的工作基础上使用N-氟苯磺酰亚胺作为亲核氮源和氧化剂,通过钴催化的氢原子转移策略发展了一种基于氮亲核试剂的高效、普适性好的自由基氢胺化反应,并实现了苯乙烯衍生物以及非活化烯烃的不对称自由基氢胺化反应。论文第一作者是博士生秦涛,通讯作者是青年教师张鸽、熊涛教授、张前教授。
含氮有机化合物广泛存在于天然产物、医药、农药等分子中,与人类日常生活密切相关。据统计,制药工业平均每六种最常用的化学反应就有一种涉及C−N构建。同时,消旋体药物的多个对映异构体与生命体作用时会在临床实验上表现出巨大差异。因此,高效、高立体选择性地合成含氮有机化合物已成为新药研发的重要研究内容之一。
烯烃的氢胺化反应是构建含氮有机化合物最直接、有效的方法之一,在过去的几十年里受到了合成界的广泛关注。近十几年来,随着过渡金属催化及光化学的迅猛发展,结合自由基反应的自身优势(反应活性高、官能团兼容性强、空间位阻影响小等),过渡金属催化的自由基化学受到了人们的高度关注,取得了系列重要进展。然而如何控制高活性自由基中间体的立体化学,实现高对映选择的转化仍是一项艰巨的挑战。目前,烯烃自由基氢胺化反应的碳自由基中间体主要是通过氮自由基对烯烃加成或烯烃的氢原子转移反应两种方式产生。近期,利用钴催化的氢原子转移反应,陆展课题组实现了烷基烯烃与酯基重氮化合物的高对映选择性氢胺化反应;Akai实现了烯烃与5-取代四氮唑的不对称氢胺化反应,对映选择性有待优化。可见,不对称的自由基氢胺化仍十分缺乏,发展高效的不对称自由基氢胺化新方法极具吸引力。
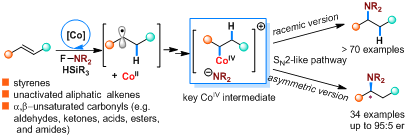
图1:钴催化烯烃与NFSI的自由基氢胺化反应
近日,东北师范大学张前教授团队发展了一种高效、普适性强的基于亲核氮源的自由基氢胺化反应,并实现了相应的不对称转化,合成了系列手性胺类化合物(图1)。该工作以Co(salen)为催化剂,N-氟苯磺酰亚胺(NFSI)为亲核氮源和氧化剂,各种烯烃,包括脂肪族端烯/內烯、苯乙烯衍生物、α,β-不饱和酯、酰胺、羧酸以及α,β-不饱和醛、酮等,都能够很好地适用,以优良的收率得到对应的氢胺化产物。如图2所示,官能团兼容性优异,常见的卤素、烷氧基、酯基、胺基、酰胺基、含硼取代基、对氟敏感的硅基以及易于还原的炔基、羰基都可以很好地保留。进一步,利用手性Co(II)-salen催化剂,可以成功实现烯烃的不对称自由基氢胺化反应。各种苯乙烯衍生物、萘乙烯衍生物都能以高的对映选择性得到相应的手性胺产物。非活化烯烃的不对称自由基氢胺化也可以顺利实现,反应的对映选择性有待进一步提升。
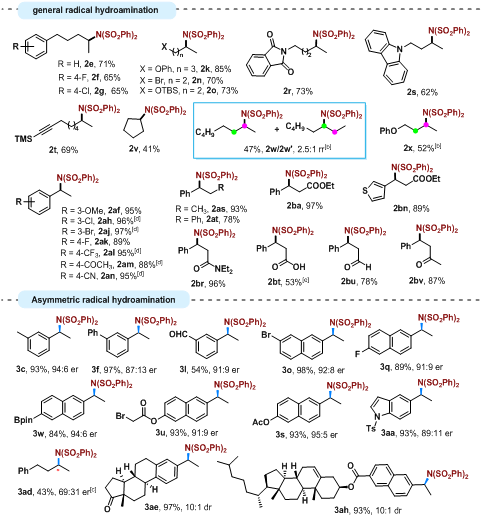
图2:代表性的氢胺化产物举例
研究还发现,该反应使用0.5 mol%的钴催化剂可以放大至克级规模,在不影响反应收率的条件下得到预期的胺化产物,具有很好的应用潜力。另外,胺化产物可以进一步衍生化转化为重要的β-氨基醇、氨基酯化合物以及天然产物和药物分子中常见的氮杂四元环化合物。在机理研究中,系列自由基抑制实验、自由基clock实验、氘代实验、Hammett研究以及初步的计量实验等表明,该反应经历了金属氢化物介导的烯烃氢原子转移,随后生成关键的高价金属中间体,再通过类似于SN2方式高对映选择性地构建C−N键(图3)。该工作为手性胺类化合物的合成提供了一个崭新的途径,同时,为使用各种亲核试剂的烯烃不对称氢官能化反应开了一扇门。

图3:可能的反应机理
相关工作得到了国家自然科学基金重点项目、青年项目和东北师范大学等的大力支持。(来源:科学网)
相关论文信息:https://doi.org/10.1002/anie.202110178