|
|
|
|
|
中科院长春应化所联合哥伦比亚大学提出脓毒症治疗新策略 |
|
|
2021年9月22日,中国科学院长春应用化学研究所陈学思院士团队的田华雨研究员与哥伦比亚大学Kam W. Leong教授合作在Matter上发表了一篇题为“Targeting multiple mediators of sepsis using multifunctional tannic acid-Zn2+-gentamicin nanoparticles”的文章。
该研究以脓毒症发病过程中多种致病因子作为治疗靶标,采用由单宁酸、锌离子以及庆大霉素构建的多功能纳米颗粒对多种致病因子进行清除,从而实现高效的脓毒症治疗效果,为脓毒症以及其他难治疗的炎症疾病提供了新的治疗策略。论文通讯作者是田华雨研究员和Kam W. Leong教授;第一作者是刘锋博士。
脓毒症是一种严重威胁生命的全身性炎症反应综合征,由于缺乏有效的临床治疗方法,患者机体的免疫功能往往发生失调,进而造成异常的系统炎症以及多器官功能损伤。虽然目前的临床治疗方案如液体复苏、机械通气、抗感染和血流动力学支持等在一定程度上可以缓解症状,但是重度脓毒症患者的死亡率仍然较高,每年仍有超过800万人死亡。
随着对脓毒症发病机制的研究深入,研究人员们已经发现多种对脓毒症的发生和发展起到重要作用的致病因子。由受损细胞的细胞核或线粒体释放的游离DNA(cfDNA),是脓毒症发病过程中常见的一类损伤相关分子模式,可以通过Toll样受体(TLR)激活免疫细胞,从而引发持续的无菌炎症反应。尽管已有采用阳离子纳米颗粒通过清除促炎cfDNA用于治疗脓毒症的报道,但阳离子材料潜在的系统毒性限制了其进一步临床应用。
LPS是脓毒症发病过程中常见的病原体相关分子模式,能够激活免疫细胞的TLR,引起一氧化氮产生和促炎细胞因子的释放。虽然采用TLR拮抗剂抑制TLR的激活可以在一定程度上缓解炎症相关疾病,但是抑制TLR功能可能会导致免疫抑制、免疫识别阈值提高以及增加感染风险等问题。此外,高表达的羟基自由基和超氧阴离子自由基等活性氧(ROS)也在脓毒症发病过程中发挥着重要作用。ROS水平升高会导致细胞内DNA损伤以及细胞功能紊乱,造成细胞死亡以及随后的cfDNA释放,从而引发持续性的全身炎症反应,并可能造成器官衰竭和死亡。
研究指出,仅针对脓毒症发病过程中单一致病因子的治疗策略并不能显著降低脓毒症造成的死亡率。在这篇研究工作中,中国科学院长春应用化学研究所田华雨研究员和哥伦比亚大学Kam W. Leong教授在室温条件下采用简单、低成本和可大规模制备的“一锅法”合成了由单宁酸、Zn2+和庆大霉素组成的多功能TA-Zn-Gen纳米颗粒,并将其应用于脓毒症治疗。
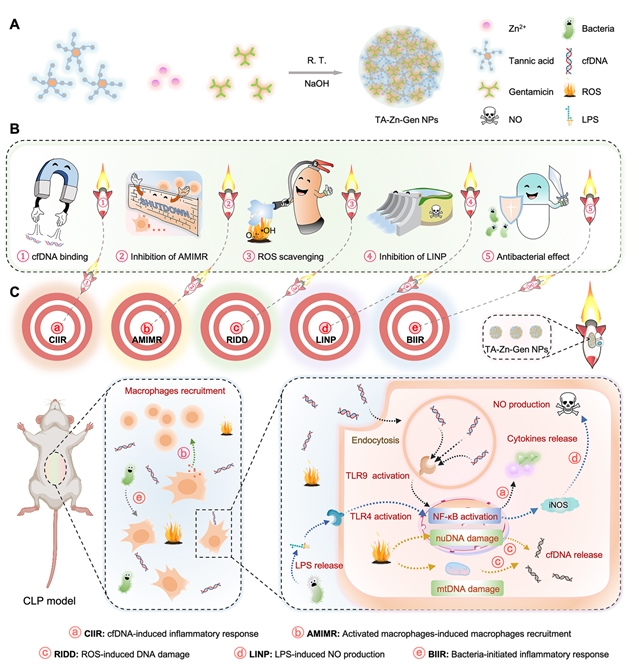
图1:纳米材料的合成及作用机制示意图。
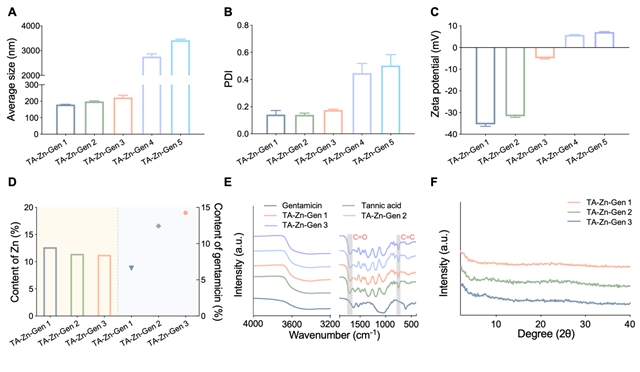
图2:纳米材料的表征结果。
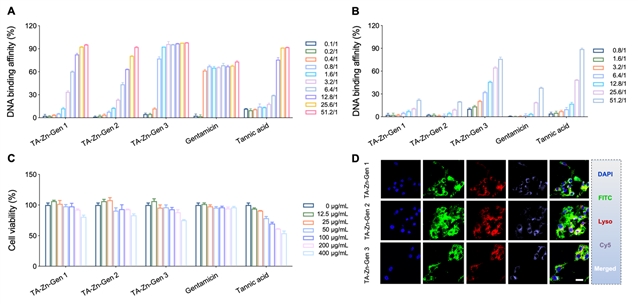
图3:纳米材料结合DNA能力研究。
研究结果显示,该材料可针对脓毒症发病过程中的多种致病因子,并通过以下五种机制实现高效的脓毒症治疗效果:(1)结合和清除促炎 cfDNA 以及抑制cfDNA诱导的TLR激活和NF-κB信号传导;(2)抑制活化的巨噬细胞诱导的巨噬细胞募集;(3)清除ROS,抑制ROS引起的DNA损伤和细胞死亡;(4)抑制LPS诱导的一氧化氮产生;(5)高效的抗菌活性以及抑制细菌引起的炎症。

图4:纳米材料抑制核酸诱导的TLR受体激活研究。
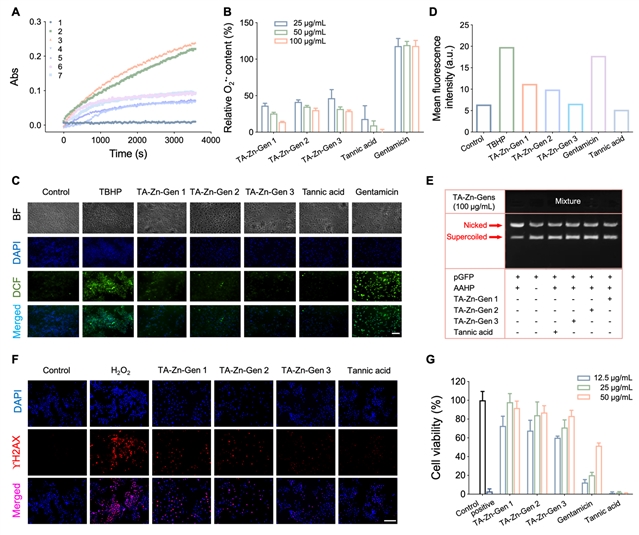
图5:纳米材料清除ROS能力研究。

图6:纳米材料抗菌能力研究。

图7:脓毒症治疗效果评价。
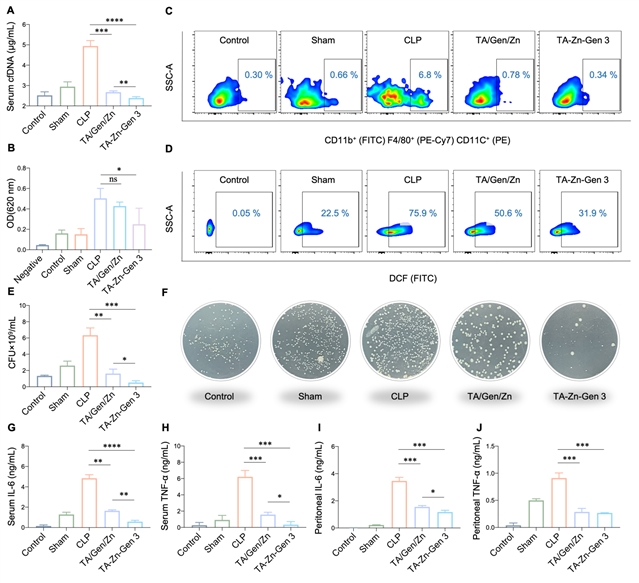
图8:体内脓毒症致病因子评价。
(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.matt.2021.09.001