近日,中国科学院广州生物医药与健康研究院研究员刘兴国、副研究员邬毅团队成功揭示了全能性与多能性转变过程中的关键转录后调控机制,首次阐明了源自逆转座子的蛋白在抑制内源病毒元件、调控细胞命运方面的独特功能。相关研究成果发表于《细胞发现》(Cell Discovery)。
论文共同通讯作者刘兴国介绍,该研究聚焦于L1td1蛋白,发现其是多能干细胞中限制全能性获得的“守门者”。一旦L1td1的功能出现“松懈”,细胞便有望回溯至生命初始的“全能”状态。具体而言,L1td1通过招募CCR4-NOT复合物,特异性地介导全能性相关基因以及内源性逆转录病毒转录本的降解。
 L1td1由逆转录转座子在进化中驯化为蛋白质,反过来抑制其“祖先”元件的活动,而担任多能性的“守卫者”。研究团队供图
L1td1由逆转录转座子在进化中驯化为蛋白质,反过来抑制其“祖先”元件的活动,而担任多能性的“守卫者”。研究团队供图
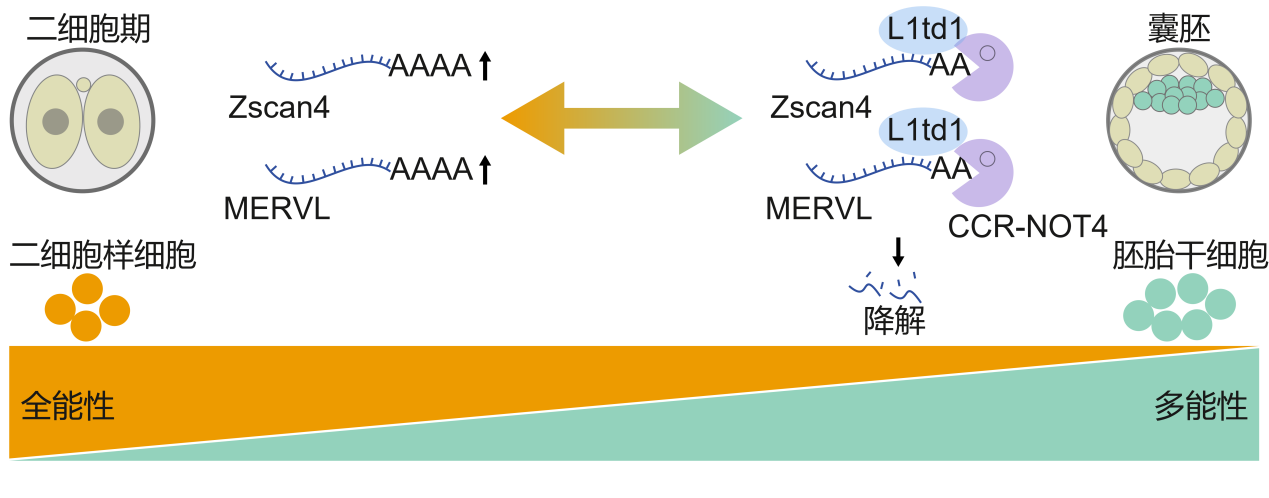
生命的起始点是一个全能受精卵,在后续的发育进程中,细胞的潜能逐步被“锁定”,逐渐转变为多能干细胞,进而失去发育成胎盘等组织的全能性。由此可见,全能性与多能性的转换是早期胚胎发育的核心环节。在二细胞胚胎期,合子基因组激活现象发生,与此同时,内源性逆转录病毒MERVL以及Zscan4等全能性基因会瞬时表达。
随着早期发育推进至囊胚期,这些基因迅速被沉默,细胞也从全能性状态转变为多能性状态。如何逆转这一过程,重新“解锁”细胞的全能状态,一直是再生医学和生命科学领域追求的终极目标之一。目前,全能性与多能性转换的转录及表观遗传调控机制已得到深入研究,然而,亚细胞水平的转录后调控,尤其是RNA降解机制,仍是一大未解之谜。
值得一提的是,L1td1本身起源于基因组中一段具有“跳跃”能力的病毒样遗传元件——LINE-1逆转录转座子。它是哺乳动物基因组中唯一由LINE-1驯化而来的蛋白编码基因,且在多能干细胞中呈现高表达状态。
在国家重点研发计划、国家自然科学基金等项目资助下,研究团队借助小鼠和人的多能干细胞模型展开研究。结果显示,当L1td1缺失时,细胞内大量全能性基因被激活,其表达特征与生命最初期的胚胎细胞(小鼠二细胞样、人八细胞样状态)极为相似,这表明细胞自发地向更原始、潜能更高的状态转变。
进一步研究发现,L1td1蛋白能够特异性识别并结合一批与全能性相关的基因(如Zscan4家族)以及一类“沉睡”在基因组中的古老病毒遗传片段(内源性逆转录病毒转座子,如MERVL-int、MT2_Mm)。它如同“守卫者”一般,借助细胞内的“降解武器”——CCR4-NOT复合物,将这些维持全能性所必需的RNA分子快速降解,从而将细胞“锁”定在多能状态。尤为重要的是,研究还发现“守卫者”L1td1能够抑制其进化上的“祖先”——LINE-1 RNA,这提示它具有广泛抑制逆转录转座子的保守功能。
该研究首次揭示了L1td1作为连接转座子沉默与细胞命运决定的关键枢纽,解析了驯化转座子蛋白通过CCR4-NO通路调控全能性的全新机制。这一发现不仅深化了我们对早期胚胎发育中RNA动态调控、基因组稳定与进化博弈的理解,更为在再生医学领域获取全能性细胞、实现异种器官再生提供了新的理论支撑。
相关论文信息:https://doi.org/10.1038/s41421-025-00864-3
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。